Prognostic Evaluation and Treatment of Autosomal Dominant Polycystic Kidney Disease
-
摘要: 常染色体显性多囊肾病(autosomal dominant polycystic kidney disease, ADPKD)患病率为1‰~2‰, 属于罕见病, 临床主要表现为双侧肾囊肿且逐渐发展, 肾脏体积进行性增大, 肾功能逐步降低。PKD1基因突变约占81%, PKD2基因突变约占10.5%~22%。血管加压素(arginine vasopressin, AVP)和环磷酸腺苷(cyclic adenosine monophosphate, cAMP)信号通路在ADPKD囊肿发展过程中发挥重要作用。近年来发表的梅奥风险评估模型和PROPKD(predicting renal outcome in polycystic kidney disease)评分是ADPKD较好的预后评估模型, 已成为临床医生决策的重要依据。通过拮抗AVP受体, 抑制cAMP通路的托伐普坦已成为ADPKD首个特异治疗药物, 可有效抑制总肾脏体积的增长和保护肾功能。药物的长期安全性仍需进一步研究。Abstract: The prevalence of autosomal dominant polycystic kidney disease(ADPKD) is 1‰ to 2‰, belonging to rare diseases. ADPKD is mainly manifested as gradually developing bilateral renal cysts, progressively increasing renal size, and gradually reduced renal function. PKD1 mutation accounts for about 81%; PKD2 mutation accounts for about 10.5% to 22%. Vasopressin and cyclic adenosine monophosphate(cAMP) signaling pathways play an important role in the development of ADPKD cysts. In recent years, the Mayo risk assessment model and predicting renal outcome in polycystic kidney disease(PROPKD) score, which are good prognostic models for ADPKD, have become important evidences for clinical decision-making. Tolvaptan, which inhibits cAMP pathway by antagonizing vasopressin receptor, has become the first specific treatment for ADPKD. Tolvaptan could effectively inhibit the growth of total renal size, and protect renal function. Long-term safety of the drug still needs further study.
-
Keywords:
- polycystic kidney disease /
- autosomal dominant /
- prognostic evaluation /
- treatment
-
输注异体红细胞是围术期快速纠正贫血的有效措施,在心血管外科手术、骨科大关节手术以及开胸手术等创伤较大的手术中尤为常见[1]。但输注异体红细胞可能导致术后切口感染、输血相关容量过负荷等不良事件[2-3]。平衡异体红细胞输注的获益与风险,是改善手术患者预后的重要环节之一[4]。我国《围术期输血指南(2014)》[5]建议采用限制性输血策略,即血红蛋白>100 g/L的患者围术期无需输注红细胞,血红蛋白70~100 g/L时根据患者心肺代偿功能等因素决定是否输注红细胞,血红蛋白<70 g/L时需输注红细胞,该策略旨在降低围术期异体红细胞输注率。限制性输血策略已实施6年余,其是否改变了围术期异体红细胞输注现状尚不清楚。本研究以行开胸肺叶切除术单病种患者为研究对象,探究我国限制性输血策略对围术期异体红细胞输注率的影响。
1. 资料与方法
1.1 研究对象
本研究是一项基于人群横断面数据形成的纵向研究,研究报告遵循STROBE报告规范[6]。研究对象为数据库中2013年1月1日至2018年8月31日我国三级医院行开胸肺叶切除术(伴或不伴淋巴结清扫)的所有患者,排除输血信息不全、同期行其他部位手术的患者。
本研究已通过北京协和医院伦理委员会审批(审批号:S-K1047)。
1.2 方法
1.2.1 数据处理
数据来源于国家卫生健康委员会管理的医院质量监测系统(hospital quality monitoring system,HQMS)病案首页数据库。共收集研究时间段内1.6亿例住院患者的临床资料。根据手术编码信息(RC022-ICD-9),提取60 089 514例至少接受1次手术的患者数据。对主要诊断、治疗方式和围术期输血数据(输注类别、数量)进行完整性分析,剔除上述变量中有缺失和错误的患者。在上述数据的基础上,根据手术编码信息,筛选行肺叶切除术(编码32.49001)和肺叶切除术伴淋巴清扫术(编码32.6002)的患者。
1.2.2 研究因素及其定义
本研究主要观察指标是患者围术期异体红细胞输注率,其定义为住院期间输注一个单位及以上的异体红细胞。粗输注率计算方法为组内存在异体红细胞输注的患者数除以组内患者总数。本研究按照“中华人民共和国行政区划”[7]将医院所在的省级行政区分类为华北、西北、东北、华东、华中、西南及华南7个地区。
1.3 偏倚控制
手术方式与出血风险密切相关,因此在评价输血情况的研究中,选择具有标准术式的开胸肺叶切除术单病种,有利于控制混杂。采用混合效应模型校正年龄和性别亦有助于减少这两个因素对结果的影响。
1.4 统计学处理
采用R 4.0.3软件进行统计学分析。不同年份或地区的异体红细胞输注情况为计数资料,以例数(百分比)表示。异体红细胞粗输注率区间估计值(95% CI)的计算采用似然比法。采用折线图展示异体红细胞粗输注率的时间变化趋势。采用混合效应Logistic回归模型评估围术期异体红细胞输注率在时间和地区间的变化,模型中将患者手术年份和地区设置为随机截距项,年龄和性别设置为校正变量,个体是否存在异体红细胞输注设置为结局变量。模型主要结果是群体水平的校正后异体红细胞输注比值比(odds ratio,OR),即调整的OR(adjusted OR, aOR)及其95% CI。该aOR值由模型中随机效应参数项的均值及方差估计而得,其含义可近似理解为某群体的异体红细胞输注率为全部人群平均异体红细胞输注率的倍数。aOR值的95% CI下限大于1时,认为某群体的异体红细胞输注率显著高于整体平均水平;95% CI上限小于1时,认为显著低于整体平均水平。
2. 结果
2.1 一般临床资料
共93 285例行开胸肺叶切除术的患者入选本研究。平均年龄为(57.52±11.85)岁,男性59 653例(63.95%)、女性33 632例(36.05%)。4367例(4.68%,95% CI:4.55%~4.82%)在围术期接受了异体红细胞输注。
年份分布上,行开胸肺叶切除术例数最多的年份是2014年(图 1);地区分布上,除西藏自治区、中国台湾、中国香港和中国澳门以外的30个省级行政区均有行开胸肺叶切除术患者的数据,其中以华东地区最多,西北地区最少。
2.2 限制性输血策略实施前后围术期异体红细胞粗输注率变化
自限制性输血策略实施后,异体红细胞年粗输注率维持在相对较低的水平(但有小范围波动)。2013至2018年,围术期异体红细胞年粗输注率依次为6.89%(95% CI:6.52%~7.29%)、5.23%(95% CI:4.93%~5.55%)、4.15%(95% CI:3.88~4.44%)、4.32%(95% CI:4.03~4.62%)、3.73%(95% CI:3.45%~4.03%)及4.37%(95% CI 3.49%~5.46%)(图 2)。
混合效应Logistic回归模型校正地区因素后,可观察到2016至2017年异体红细胞输注率输注率明显低于2013至2014年。异体红细胞输注率整体呈下降趋势,以2017年最低,2018年稍有反弹。进一步校正患者年龄及性别后,整体下降趋势未改变(表 1)。
表 1 混合效应Logistic回归模型估算不同年份间异体红细胞输注率变化[aOR(95% CI)]年份 校正地区 校正地区、患者年龄及性别 2013年 1.45(1.20~1.75) 1.45(1.20~1.75) 2014年 1.07(0.89~1.30) 1.07(0.89~1.30) 2015年 0.84(0.70~1.02) 0.84(0.69~1.02) 2016年 0.83(0.68~1.01) 0.83(0.68~1.01) 2017年 0.82(0.67~1.00) 0.82(0.68~1.00) 2018年 1.12(0.84~1.48) 1.12(0.85~1.48) aOR:调整的比值比 2.3 围术期异体红细胞粗输注率的地区差异
我国行开胸肺叶切除术患者围术期异体红细胞输注率存在显著的地区差异。西北地区(11.68%,95% CI:10.41%~13.08%)、华中地区(10.21%,95% CI:9.74%~10.71%)及西南地区(8.29%,95% CI:7.83%~8.77%)的异体红细胞粗输注率均约为华东地区的10倍(1.11%,95% CI:1.01%~1.23%),华北地区(4.96%,95% CI:4.57%~5.37%)约为华东地区的5倍。
混合效应Logistic回归模型校正年份后,仍可见西北地区的异体红细胞输注率最高,约为华东地区的10倍。进一步校正患者年龄、性别后,仍可见类似结果,提示围术期异体红细胞输注率可能存在较大的地区差异(表 2)。
表 2 混合效应Logistic回归模型估算不同地区间异体红细胞输注率变化[aOR(95% CI)]地区 校正年份 校正年份、患者年龄及性别 西北 2.75(2.20~3.43) 2.74(2.19~3.42) 华中 2.30(1.90~2.78) 2.28(1.88~2.75) 西南 1.90(1.57~2.30) 1.90(1.57~2.30) 华北 1.06(0.86~1.29) 1.06(0.86~1.29) 东北 0.64(0.52~0.79) 0.64(0.52~0.79) 华南 0.54(0.42~0.69) 0.54(0.42~0.69) 华东 0.23(0.19~0.29) 0.23(0.19~0.29) aOR:同表 1 3. 讨论
本研究纳入了我国三级医院9万余例行开胸肺叶切除术患者,发现2013至2018年围术期异体红细胞年粗输注率整体呈下降趋势,但存在显著的地区差异。相对2013年,2018年的围术期异体红细胞年粗输注率下降了36.57%。地区方面,以西北地区的异体红细胞粗输注率最高,约为华东地区的10.52倍。混合效应Logistic回归模型校正患者年龄、性别及地区等混杂因素后,仍可见类似的下降趋势以及地区间差异,提示虽然我国围术期异体红细胞输注整体出现下降,但用血实践存在较高的异质性,血液管理有较大的提升空间。
随着围术期血液管理项目的实施与推广,发达国家已开展了多个基于全国人群的观察性研究以了解其血液管理的成效,发现围术期异体红细胞输注率下降了20%~70%[1, 9-12]。相较发达国家,我国血液资源供需关系更加紧张[13],但我国尚缺乏全国范围内用血实践的相关研究[14]。本研究充分挖掘我国HQMS数据库,发现2013至2018年我国三级医院行开胸肺叶切除术患者围术期异体红细胞输注率下降了约1/3。围术期异体红细胞输注率下降的原因可能与采用微创手术、手术技术进步等因素减小了手术创伤、降低了输血需求有关。本研究纳入的均为行开胸肺叶切除术这一相对标准术式的患者,可初步排除手术方式的影响。近10年来,我国合理用血意识及血液管理水平不断提高。本团队参与的一项回顾性研究调查了我国4家大型医院外科患者用血情况,发现2009至2011年间异体红细胞合理输注率由58.5%(95% CI:52.1%~64.8%)上升至69.8%(95% CI:65.3%~74.1%)[15]。随后国家卫生健康委员会(原国家卫生和计划生育委员会)调查发现,2011至2013年间我国术中异体红细胞使用量呈明显下降趋势,且自体血回收使用率由4%提高至7%[16]。为进一步加强围术期用血管理,我国颁布了《围术期输血指南(2014)》[5],提倡成分输血,并通过多种措施避免或减少异体血输注。本研究结果提示,限制性输血策略的实施可能在降低异体红细胞输注率中发挥重要作用。
探究围术期异体红细胞输注率为进一步优化血液管理提供了依据。本研究发现,我国围术期异体红细胞输注率在不同地区间差异悬殊,提示我国各地区的围术期用血实践存在较高的异质性。一项Meta分析总结了我国各地区红细胞不合理输注率,由高至低依次为东北(33.43%)、华南(29.03%)、华中(28.93%)、西北(21.78%)、华东(21.75%)、华北(20.66%)及西南地区(19.38%)[17]。虽然这些结果来自二级及三级医院的手术和非手术科室,且样本量远小于本研究,不能完全解释本研究中三级医院行开胸肺叶切除术患者异体红细胞输注率在不同地区的分布特征,但能反映出各地区医院的临床用血存在较大差异。这可能与医生对输血的潜在风险重视程度不够,合理用血意识不强、不同地区的用血习惯或限制性输血策略落实的程度不同有关,亦提示目前我国血液保护技术未普及或不成熟、用血评价制度不健全。值得欣慰的是,全国21家围术期血液管理培训中心已开始分区域开展围术期血液管理的继续教育工作[18];各地区已将临床用血管理作为评价医疗质量的重要指标[19];三级医院正带动二级医院加速推进合理用血进程[19]。期待这些措施能够促进我国围术期血液管理均衡发展。
各地区围术期异体红细胞输注率的较大差异亦反映了制定输血决策的复杂性。是否需要输血、输血量多少需综合诸多因素,很难有统一的规范适用于各种复杂的临床情境。如虽然限制性输血策略划定了必须输血及不必要输血患者的血红蛋白阈值,但血红蛋白浓度在70~100 g/L时应如何用血尚缺乏具体说明,且目前尚不确定限制性输血策略能否影响肿瘤、颅脑损伤患者的临床结局[20-21]。此外,术中患者快速出血时,常无法顾及其血红蛋白浓度,需立即根据出血原因、手术复杂性、患者生理状态等因素快速作出是否输血的决断。因此,合理输血的实现一方面有待更多高质量的研究针对不同人群及临床情境,探究并制定出更具指导性、更具体的输血策略;另一方面,预防失血可能是更好的血液保护措施。
近年来,围术期血液管理的关注重点正从血液制品转移至患者本身。国家卫生健康委员会于2017年提出稳步推进“患者血液管理(patient blood management,PBM)”的要求,计划建立健全以单病种质量管理为基础的临床用血评价制度[19]。PBM是基于循证医学和多学科联合的方法,着力保护并妥善利用患者自身血液资源,具体措施包括优化患者红细胞质量、减少失血与出血及提高患者对贫血的生理耐受力3个方面[4]。近年来,我国发布了《中国骨科手术加速康复—围术期血液管理专家共识(2017)》[22]《心血管手术患者血液管理专家共识(2018)》[23]及《妇科围术期患者血液管理的专家共识》[24]等一系列文件,正在联合多学科共同推动围术期患者血液管理的科学化及规范化发展。本研究调查了开胸肺叶切除术单病种临床用血情况,可为围术期胸外科PBM的制定及推进提供参考。
本研究存在以下局限性:(1)由于用血数据并非数据库对接时的强核查信息,可能存在记录不准确或遗漏的情况,基于HQMS病案首页记录判断患者输血状态可能存在信息偏倚。(2)HQMS设立的目的是进行医院质量管理,部分三级医院在本研究申请的数据时间内(2013至2018年)尚未链接该数据系统。因此,本研究未能涵盖全部三级医院的病案首页数据,样本量较小地区的异体红细胞输注率估计值可能不稳定,相应的分析结果应谨慎参考。(3)尽管选取了单病种具有标准术式治疗的疾病进行分析,且采用混合效应Logistic回归模型校正了患者年龄、性别等混杂因素,但其他指标亦可能影响红细胞的输注,如术前血红蛋白、术中出血量、病灶大小等,而这些指标在HQMS数据库中并未记录,因此无法对其他重要混杂因素进行充分校正。(4)由于无法获知患者输血前的贫血程度及生命体征等重要信息,因此无法判断这些输血是否依照限制性输血策略执行,不能评价用血实践的合理性。(5)本研究仅分析了异体红细胞输注率的变化,未探究血浆、血小板等其他异体血制品的使用情况。因此,本研究结果外推时应谨慎。
综上,自围术期限制性输血策略实施以来,我国三级医院行开胸肺叶切除术患者的围术期异体红细胞输注率明显下降,但存在显著的地区差异。提示我国围术期用血实践正在发生改变。期望随着输血学科建设及人才培养体系的成熟,血液管理理念及技术的推广普及,我国围术期血液管理可获得更加科学、均衡的发展。
-
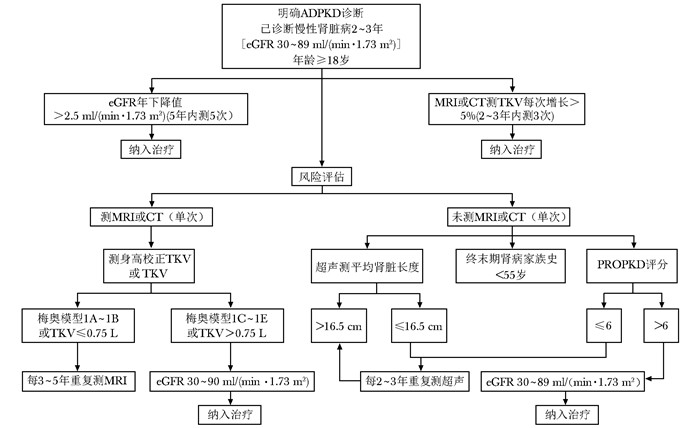
图 1 NICE指南制定的ADPKD诊疗决策流程图
ADPKD、TKV、eGFR、ESRD:同表 1; MRI:磁共振成像;NICE:英国国家卫生保健优化研究所
表 1 ADPKD的梅奥风险评估模型
模型 1A 1B 1C 1D 1E TKV年增长率(%) <1.5 1.5~3.0 3.0~4.5 4.5~6.0 >6.0 eGFR年下降值[ml/(min·1.73 m2)] 0.1 -1.2 -2.5 -3.4 -4.6 10年ESRD发病风险(%) 2.4 11.0 37.8 47.1 66.9 ADPKD:常染色体显性多囊肾病;TKV:总肾脏体积;eGFR:肾小球滤过率估计值;ESRD:终末期肾病 -
[1] Neumann HP, Jilg C, Bacher J, et al. Epidemiology of autosomal-dominant polycystic kidney disease:an in-depth clinical study for south-western Germany[J]. Nephrol Dial Transplant, 2013, 28:1472-1487. DOI: 10.1093/ndt/gfs551
[2] Xue C, Zhou CC, Wu M, et al. The clinical manifestation and management of autosomal dominant polycystic kidney disease in China[J]. Kidney Dis(Basel), 2016, 2:111-119. DOI: 10.1159/000449030
[3] Ong AC, Devuyst O, Knebelmann B, et al. Autosomal dominant polycystic kidney disease:the changing face of clinical management[J]. Lancet, 2015, 385:1993-2002. DOI: 10.1016/S0140-6736(15)60907-2
[4] Sommerer C, Zeier M. Clinical manifestation and manage-ment of ADPKD in western countries[J]. Kidney Dis(Basel), 2016, 2:120-127. DOI: 10.1159/000449394
[5] Steinman TI. Polycystic kidney disease:a 2011 update[J]. Curr Opin Nephrol Hypertens, 2012, 21:189-194. DOI: 10.1097/MNH.0b013e32835011a7
[6] Mao Z, Chong J, Ong AC. Autosomal dominant polycystic kidney disease:recent advances in clinical management[J]. F1000Res, 2016, 5:2029. DOI: 10.12688/f1000research.9045.1
[7] Chen L, Zhou X, Fan LX, et al. Macrophage migration inhibitory factor promotes cyst growth in polycystic kidney disease[J]. J Clin Invest, 2015, 125:2399-2412. DOI: 10.1172/JCI80467
[8] Ong AC, Harris PC. Molecular pathogenesis of ADPKD:the polycystin complex gets complex[J]. Kidney Int, 2005, 67:1234-1247. DOI: 10.1111/j.1523-1755.2005.00201.x
[9] Porath B, Gainullin VG, Cornec-Le Gall E, et al. Mutations in GANAB, encoding the glucosidase Ⅱα subunit, cause autosomal-dominant polycystic kidney and liver disease[J]. Am J Hum Genet, 2016, 98:1193-1207. DOI: 10.1016/j.ajhg.2016.05.004
[10] Audrezet MP, Cornec-Le Gall E, Chen JM, et al. Autosomal dominant polycystic kidney disease:comprehensive mutation analysis of PKD1 and PKD2 in 700 unrelated patients[J]. Hum Mutat, 2012, 33:1239-1250. DOI: 10.1002/humu.22103
[11] Ong AC, Harris PC. A polycystin-centric view of cyst formation and disease:the polycystins revisited[J]. Kidney Int, 2015, 88:699-710. DOI: 10.1038/ki.2015.207
[12] Harris PC, Torres VE. Genetic mechanisms and signaling pathways in autosomal dominant polycystic kidney disease[J]. J Clin Invest, 2014, 124:2315-2324. DOI: 10.1172/JCI72272
[13] Grantham JJ, Torres VE, Chapman AB, et al. Volume progression in polycystic kidney disease[J]. N Engl J Med, 2006, 354:2122-2130. DOI: 10.1056/NEJMoa054341
[14] Chapman AB, Bost JE, Torres VE, et al. Kidney volume and functional outcomes in autosomal dominant polycystic kidney disease[J]. Clin J Am Soc Nephrol, 2012, 7:479-486. DOI: 10.2215/CJN.09500911
[15] Bhutani H, Smith V, Rahbari-Oskoui F, et al. A compar-ison of ultrasound and magnetic resonance imaging shows that kidney length predicts chronic kidney disease in autosomal dominant polycystic kidney disease[J]. Kidney Int, 2015, 88:146-151. DOI: 10.1038/ki.2015.71
[16] Pei Y, Obaji J, Dupuis A, et al. Unified criteria for ultrasonographic diagnosis of ADPKD[J]. J Am Soc Nephrol, 2009, 20:205-212. DOI: 10.1681/ASN.2008050507
[17] Simms RJ, Travis DL, Durkie M, et al. Genetic testing in the assessment of living related kidney donors at risk of autosomal dominant polycystic kidney disease[J]. Transplanta-tion, 2015, 99:1023-1029. DOI: 10.1097/TP.0000000000000466
[18] Zong C, Lu S, Chapman AR, et al. Genome-wide detection of single-nucleotide and copy-number variations of a single human cell[J]. Science, 2012, 338:1622-1626. DOI: 10.1126/science.1229164
[19] Chapman AB, Devuyst O, Eckardt KU, et al. Autosomal-dominant polycystic kidney disease(ADPKD):executive summary from a Kidney Disease:Improving Global Outcomes(KDIGO) Controversies Conference[J]. Kidney Int, 2015, 88:17-27. DOI: 10.1038/ki.2015.59
[20] Schrier RW, Brosnahan G, Cadnapaphornchai MA, et al. Predictors of autosomal dominant polycystic kidney disease progression[J]. J Am Soc Nephrol, 2014, 25:2399-2418. DOI: 10.1681/ASN.2013111184
[21] Cornec-Le Gall E, Audrezet MP, Rousseau A, et al. The PROPKD score:a new algorithm to predict renal survival in autosomal dominant polycystic kidney disease[J]. J Am Soc Nephrol, 2016, 27:942-951. DOI: 10.1681/ASN.2015010016
[22] Irazabal MV, Rangel LJ, Bergstralh EJ, et al. Imaging classification of autosomal dominant polycystic kidney disease:a simple model for selecting patients for clinical trials[J]. J Am Soc Nephrol, 2015, 26:160-172. DOI: 10.1681/ASN.2013101138
[23] Xue C, Zhou C, Dai B, et al. Antihypertensive treatments in adult autosomal dominant polycystic kidney disease:network meta-analysis of the randomized controlled trials[J]. Oncotarget, 2015, 6:42515-42529. DOI: 10.18632/oncotarget.6452
[24] Torres VE, Abebe KZ, Chapman AB, et al. Angiotensin blockade in late autosomal dominant polycystic kidney disease[J]. N Engl J Med, 2014, 371:2267-2276. DOI: 10.1056/NEJMoa1402686
[25] Walz G, Budde K, Mannaa M, et al. Everolimus in patients with autosomal dominant polycystic kidney disease[J]. N Engl J Med, 2010, 363:830-840. DOI: 10.1056/NEJMoa1003491
[26] Serra AL, Poster D, Kistler AD, et al. Sirolimus and kidney growth in autosomal dominant polycystic kidney disease[J]. N Engl J Med, 2010, 363:820-829. DOI: 10.1056/NEJMoa0907419
[27] Caroli A, Perico N, Perna A, et al. Effect of longacting somatostatin analogue on kidney and cyst growth in autosomal dominant polycystic kidney disease(ALADIN):a randomised, placebo-controlled, multicentre trial[J]. Lancet, 2013, 382:1485-1495. DOI: 10.1016/S0140-6736(13)61407-5
[28] Torres VE, Chapman AB, Devuyst O, et al. Tolvaptan in patients with autosomal dominant polycystic kidney disease[J]. N Engl J Med, 2012, 367:2407-2418. DOI: 10.1056/NEJMoa1205511
[29] Torres VE, Chapman AB, Devuyst O, et al. Multicenter, open-label, extension trial to evaluate the long-term efficacy and safety of early versus delayed treatment with tolvaptan in autosomal dominant polycystic kidney disease:the TEMPO 4:4 Trial[J]. Nephrol Dial Transplant, 2017. doi: 10.1093/ndt/gfx043.[Epub ahead of print].
[30] Torres VE, Higashihara E, Devuyst O, et al. Effect of tolvaptan in autosomal dominant polycystic kidney disease by CKD stage:results from the TEMPO 3:4 trial[J]. Clin J Am Soc Nephrol, 2016, 11:803-811. DOI: 10.2215/CJN.06300615

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS


 下载:
下载: