新型冠状病毒抗原快速检测专家共识(2022)
详细信息Expert Consensus on Rapid SARS-CoV-2 Antigen Testing(2022)
-
摘要: 新型冠状病毒肺炎疫情持续时间长、流行范围广,给全球公共卫生带来了巨大负担。作为感染早期诊断和疫情防控的主要检测手段之一,新型冠状病毒抗原快速检测已在国内逐步开展临床应用。就目前医务人员和社会公众所关注的新型冠状病毒抗原检测相关问题,中国医院协会临床微生物实验室专业委员会组织医学检验、临床医学、感染控制、公共卫生及体外诊断产品研发等多领域专家,依据国内外最新研究进展和应用实践,共同制定了《新型冠状病毒抗原快速检测专家共识(2022)》。本共识介绍了目前新型冠状病毒抗原快速检测方法的技术原理、性能特点、结果解读及处置建议,并就不同场景下新型冠状病毒抗原快速检测应用策略和注意事项进行了解析,以期为临床诊疗和疫情防控中正确理解和应用这一检测技术提供参考建议。Abstract: The epidemic of the highly contagious, long lasting and widely popular coronavirus disease 2019 (COVID-19) has imposed a huge burden to the global public health. As one of the key methods for early diagnosis of COVID-19 infection, rapid acute respiratory syndrome coronavirus 2 (SARS-CoV-2) antigen testing has been gradually applied in China. To address concerns raised by both health care workers and the public, based on the latest research and clinical practices, the Sub-committee of Clinical Microbiology Laboratory, Chinese Hospital Association proposed Expert Consensus on Rapid SARS-CoV-2 Antigen Testing (2022). The consensus panel is composed of experts from multiple disciplines, including laboratory medicine, clinical medicine, infection control, public health, research and development of in vitro diagnostic products. The consensus describes its principle, technological characteristics, results interpretation and disposal recommendations, and analyzes the strategies and matters needing attention in different application scenarios. We expect the consensus to help correct understanding and application of rapid SARS-CoV-2 antigen testing in the diagnosis, treatment, prevention, and control of COVID-19.
-
基于人工智能大模型和生成交互式智能技术(如ChatGPT等)的成功和迅速传播,又一次在全球范围激发了大众对于生成式人工智能和通用人工智能技术无限的想象[1]。正如黑格尔所言,“历史总是惊人地重演”,人们似乎已忘却7年前对于人工智能程序AlphaGo大胜人类围棋高手后的惊呼和期盼[2],对于ChatGPT的反应,依然遵循“我们从历史中学到的教训,就是没有从历史中学到教训。”
当前人工智能技术取得的进展,对于医学医疗的影响究竟如何?6年前,因为对人工智能核心技术深度学习的贡献而获图灵奖的Hinton教授曾经预言[3]:“应停止培养放射科医生,在5年之内,深度学习将会比放射科医生做得更好”。而事实是:尽管深度学习相关研究已在近期取得了巨大进展,但“停止培养放射科医生”非但未能成为选项,还迫使我们必须加快加强培养更多更好的新型放射科医生。然而,我们不能掉以轻心,ChatGPT技术表明,当基础模型(foundation models)广泛应用时,将迫使各行各业发生巨大变革,特别是医学健康事业,我们必须准备好应对快速“相变”式的冲击。
如何应对?对此已有较多专业性的讨论[4-13]。然而,笔者认为,面对现代医学的复杂性和智能技术的强力冲击,第一要务则是“变革思维”。若借用开创国家大规模资助科学研究的先驱Vannevar Bush科学散文[14]中的精神,即是“我们不再应对!我们自由畅想!”为此,本文基于著名科学哲学家波普尔关于现实组成的三个世界之本体论观点,讨论诸如ChatGPT之类技术对平行医生和平行医院的强力推动作用,探索智慧医学的“三个三”理念,即(1)三类医生:数字人医生、机器人医生、生物人医生;(2)三种模式:“上午(AM)”自主模式(autonomous modes)、“下午(PM)”平行模式(parallel modes)、“晚间(EM)”专家模式(expert modes)或应急模式(emergency modes);(3)三大技术:医学基础模型、医疗场景工程、医用操作系统,以期从根本上减轻医护人员的负担,特别是心理负担,深度发掘医患之间的人本共情,在强化传统医学医疗社会伦理和设施的同时,推动“患者拥有个性化和私人专属的数字医院”成为一项可行的普适技术。
1. 平行化医学:三个世界,三类医生
正如文献[15-17]所述,“借鉴波普尔的关于现实的三个世界之科学哲学观点,我们可细化人类对现实的认知。”在此基础上,应重新认识医用机器和医疗软件在医学中的作用,进而重塑医学科学过程,使之与时代的智能科技相适应。当务之急,应确立“三个世界,三类医生”的医学新框架,明确独立的数字人医生概念,协调其与机器人医生(如更先进的达芬奇式手术机器人)和生物人医生之间的关系,使ChatGPT开启的人工智能大模型技术以“小问题,大模型”方式在医学领域快速实施落地,从基于第一物理世界的医学之“专业分工”,基于第二心理世界的医学之“人机分工”,尽快迭代为基于第三人工世界的医学之“虚实分工”,如图 1所示。
换言之,由于ChatGPT的成立,“小问题、大模型”的新医学范式成为可能。为避免由于大模型的算力和软件的复杂性使人类医生无法主导甚至更加“劳累”,我们必须要求未来的医学软件系统以“数字人”的形式重新设计并组织流程,特别是人机交互流程。唯有如此,才可能迫使计算机、机器人及其软件以“生物人为本”,增加机器和软件的复杂性,减少人类的认知载荷与体力要求:人类医生只要以其日常熟知的与“人”相处的方式就可以与日益智能的医学系统交互,并有效地实现自己的目标,而无需掌握越来越多的功能选择,越来越复杂的操作要求。即智能医学系统必须对人类的操作要求越来越简单,对系统的功能要求越来越复杂。
根据目前的技术发展趋势,未来每一个医学“小问题、大模型”就是一类数字人医生。如图 2所示,其数量应占医生数量的绝大多数,比如80%以上,而机器人医生和生物人医生应为少数,比如分别在15%和5%以下。因为未来社会一定是一个以服务器为技术基础设施的算力世界,无论使用与否,这些服务器都在耗能。因此,必须使之成为大量数字人“居住并工作的世界”,加以充分利用,只有这样才能保障社会的可持续发展。而机器人与生物人在本质上耗能,加上考虑人性的要求,因此它们不应该成为中低层生产和服务的主体。
这一新的认知将对未来的医学教育和医疗管理带来巨大冲击:我们将不可避免地像培养人类医生一样“培养”数字人医生,像管理人类医生一样“管理”数字人医生。换言之,我们必须变革目前的医学教育体系,使之数字化,使医用“AlphaGo”和“ChatGPT”之类的人工智能系统成为这些体系的标准组成,使人类的学习和数字人的学习交互进行、相辅相成,真正实现人在回路的强化学习模式。而且,就像人类医学生必须考试成功才能从业一样,数字人医生也必须通过各类医学场景工程的考核才可以被认证后使用,并可以再学习再使用,如同人类的继续教育或终身教育一样。虽然对于医院中数字人医生的使用管理,也存在与医学教育同样的情景与问题[18]。
由此,医学本身必须成为虚实互动的平行医学[19-22],ChatGPT已揭示了这是不可阻挡的技术发展趋势。如目前国际已兴起的“工业5.0”理念所表明的,医学也将从基于“工业4.0”的深度医疗理念[23]进入集人机物为一体的“Cyber-Physical-Social Systems(CPSS)”医学5.0(Medicine 5.0)时代[24-26]。
2. 人本化医疗:三种模式,以人为本
数字人医生的引入,可使医患之间的深度共情问题成为一个更加科学化的研究问题,未来的医学将进入一种新的范式。如有关数字人的个性设计和心理分析研究所表明的[27-28],数字人、机器人和生物人医生之间将形成一种平行互动的医疗流程,以提高医疗机构的整体水平和效率。
最重要的是,数字人医生的引入,使平行医生的构建与应用成为可能。平行医生利用数字人、机器人和生物人医生之间的平行互动是未来医疗健康的一大趋势。机器人和数字人医生可以通过远程诊疗和医学图像识别等技术为患者提供更好的服务,而AI基础模型平台则可以帮助医生更好地处理和分析患者数据和信息,提高医疗保健机构的效率和准确性[29-31]。如图 3所示,利用数字人、机器人和生物人医生之间的平行互动和流程设计,未来智慧医疗将进入一种新的范式:
(1) “上午(AM)”模式,即医疗自主模式(autonomous modes for medical operations)。此时,人类医生的主要责任是监控与巡视,用于培训和预防万一。主要操作由机器人医生在数字人医生的辅助下完成,这种医疗模式应占全部医疗操作与流程的80%以上。如果这种模式无法完成任务,将进入下一模式。
(2) “下午(PM)”模式,即医疗平行模式(parallel modes for medical operations)。此时,人类医生的主要责任是远程或云端遥控与指导,用于“上午”模式无法完成其任务的情景。主要操作由机器人医生在人类医生的指导和数字人医生的协助下完成,这种医疗模式应占全部医疗运作与流程的15%以下。如果这一模式成功完成任务,将返回“上午”模式,否则进入下一模式。
(3)“晚间(EM)”模式,即医疗专家/应急模式(expert/emergency modes for medical operations)。此时,为了确保特殊任务或应对紧急情况,必须启用人类医学专家资源,并确保他们能像“快递”一般进入现场,完成任务,并撤离现场,然后回到“下午”模式进行观察,保证操作成功。这种“晚间”模式,应占全部医疗操作与流程的5%以下。
我们称这三种医疗模式为智慧医疗新范式“MAPeM”,其目标是在大幅度减少人类医生体力与精神负担的前提下,进一步加强人类的医疗主导权,深化医患共情,大幅提高医疗效果,并使大规模个性化、人性化医疗可经济化运作。
笔者认为,智能技术和智慧医疗必须以人为本,复杂先进的医疗系统不应让医生和患者的决策越来越复杂,而应越来越简洁;智能先进的医疗技术不是要求医生和患者的智力水平越来越高,而是越来越自然和一般。
3. 智能化医院:三大技术,子虚乌有
实施三类医生及其三种模式必须有相应的支撑体系,这就是通过物理上的实体医院与云端里的数字医院之间的虚实互动平行执行所构成的平行医院[22, 32-33],如图 4所示。在这里,数字医院并非一般意义上的医院数字化,而是以数字技术重构并由平行医生操作的独立医院,其与传统实体医院紧密相联,但不对其依附,主要由数字人和机器人医生管理和维护。
借用智能军事的术语,通过智能技术的应用,我们可以使平行医院达到“子虚之医,乌有之患,招之即来,挥之即去”的境地[34]:利用虚实资源和计算医学实验,在与疾病的斗争中,让医者“招之即来”,让病痛“挥之即去”,这是西方军事马赛克和认知战的核心和精髓。为此,需要利用人工智能构建面向医学医疗的三项新技术。
医学基础模型:基础模型是目前最先进的人工智能模型之一,包括ChatGPT在内的各种生成式大模型[13]。基础模型通常使用Transformer[35]为主要网络结构,具有极高的语言模型表现力和智能度,不仅可以生成高质量的自然语言文本,还具备强大的问答、阅读理解等功能。医学基础模型可以通过处理医疗文本数据以支持医疗决策,例如应用于医疗问答系统,通过数据挖掘,分析患者病历中的症状、药品和疾病等信息,为患者提供诊断建议。当前,基础模型是机器学习的一种“子集”,但随着技术发展,其亦将逐渐向通用人工智能方向发展。通过平行学习[36-37]、深度学习和模型推理等技术的完善,基础模型可以应用于跨越多种医疗领域的任务,同时也为通用人工智能领域带来更多医疗创新思路。
医疗场景工程:人工智能研发者已初步开发了最为流行的生成式基础模型,包括语言、视觉和业务等模型,如GPT、GPT-2、GPT-3、BERT、Turing NLG、VMoE、DALL·E、DreamFusion等。这促进了医疗基础模型的设计、调试和验证,需要在特定场景下进行任务细化。平行医生与平行医院所提出的医疗基础模型将在医疗场景工程中完成模型的校准和认证(C&C)、验证和确认(V&V)[38]。医疗场景工程通过提示工程(prompt engineering)技术,在医生介入较少的情况下自动推导出完成任务所需的医疗诊断提示,生成可解决特定疾病的基础模型和治疗方案。医疗场景工程的关键是如何使用少量人工标注的样本进行探索和学习,并通过对医学任务的样本数据进行学习和挖掘,为疾病诊疗提供指导,提高医疗机构的效率和准确性,同时降低医护人员的负担。医疗场景工程是智能技术和智能化医疗的新突破口,其结构化和有序化组织对于基础模型的发展至关重要,将进一步发展催生一系列变革性的医疗技术。
医用操作系统:智能化医院是运用各种信息技术和智能设备提高医疗服务效率和质量,满足不同患者医疗需求的医院。构建智能化医院必需的关键技术支持包括医学基础模型和医疗场景工程,而医用操作系统则是实现智能化医院的重要关键技术之一。医用操作系统专为智能化医疗场景设计和开发,其特点是专业、规范、可靠和安全。与传统计算机操作系统不同,医用操作系统的设计和开发需考虑医疗信息的特殊性和隐私保护的要求,因此,区块链[39]、智能合约[40]和联邦智能[41]等也显得更为重要。医用操作系统广泛应用于各种医疗设备的控制、监测和管理中,如手术机器人、数字化医疗影像设备和生命支持设备等,通过联网和数据分析等技术手段,实现智能化设备的远程控制和监测,提升医疗设备的使用效率和管理效果,提高医疗服务的精准度和安全性。医用操作系统也能够通过智能化辅助诊断和决策支持功能,为医疗行业提供更为精准、快速、高效的诊疗服务。未来,医学基础模型、医疗场景工程和医用操作系统等技术将为医疗保健行业带来更多的机遇和挑战,需要更多的创新者和技术引领者来推动医疗保健行业发展,提升医生和患者的体验感和满意度,解决各种技术和安全问题,以推动医疗保健行业的可持续和健康发展。
4. 新医学之真道(TRUE DAO):从DeSci到DeMed
平行医学和平行医院还需要我们变革医疗“硬件”理念,必须大力发展可移动和社区化的医疗装备,甚至无人医疗装备,试验“患者不动,医者动”和“医院分布于千家万户”的“快递”式医疗和健康服务体系。更为重要的是,必须从科学和技术上最大可能地保证患者的隐私权和正当权益。为此,必须加快研究针对医学医疗的区块链技术、智能合约方法和DAO (decentralized autonomous organizations and operations)系统,大力推动其广泛应用,使医疗健康服务过程的记录不可篡改,数据可溯源,隐私和权益不可侵犯,从而走上“真道”(TRUE DAO):“T”可信(trustable)、“R”可靠(reliable)、“U”可用(useful)、“E”益效(effective/efficient);“D”分布开放(distributed/decentralized)、“A”自动自主(automated/autonomous)、“O”组织有序(organized/ordered)。
基于区块链、智能合约和DAO,世界范围内一大批以青年学者为主力的科研人员正热火朝天地开启一场分布开放式科学运动(decentralized/distributed autonomous science movement,DeSci),且医学、医疗、医药、生物学等均是这场运动的重要组成部分,得到了社会各界的关注和支持,如图 5所示。由DeSci已引发分布开放经济(DeEco)与分布开放生态和社会系统(DeSoc),研究趋势表明,开展相关分布开放医学医药(DeMed)和分布开放医疗医院(DeHospitals)研发日益重要和迫切。
![]() 图 5 分布开放科学与生态现状[42]
图 5 分布开放科学与生态现状[42]5. 展望
未来,平行医生和平行医院将使医疗进入数字化和智能化的新阶段。通过医学基础模型、医疗场景工程和医用操作系统等技术,生物人医生将管理、指导和协助数字人医生和机器人医生,并利用智能系统作出医疗决策,以提高医疗保健水平,在更好服务于患者的同时降低医疗工作者的负担。医疗模式从此将进入MAPeM新范式,人类医生不会“失业”,但会利用数字人医生和机器人医生降低社会医疗经济和生态成本。平行医生和平行医院面临的挑战,是如何让生物人医生具有优质诊断效果的同时减轻其认知负担,以及让数字人医生和机器人医生具有与生物人医生相当的智慧和能力。解决上述问题需要平行医学、数字人个体和医疗场景工程等有机结合,这将为诊断和治疗流程的重构演化提供支持。例如,平行医院和平行医生将面向医学基础模型、DAO[43]、DeSci[44]、DeSoc和DeHospitals等,与传统医疗体系结构实现一体化,成为培养生物人医生的“数字大学”和“数字研究所”。医疗的知识产品是“平行医生”和“平行医院”,数字人医生和机器人医生将不断更新迭代,建立智慧生态,实现医学知识自动化,建设包含认知医疗、平行医疗、加密医疗、联邦医疗、社会医疗、生态医疗的“6I”医疗体系,使医生工作者及其组织和团体进入“6S”境界[45]:物理世界安全(Safety),赛博空间安全(Security),生态体系可持续(Sustainability),个体隐私和权益得到保护(Sensitivity),有良好的服务(Service)和符合人类价值观的智慧(Smartness)。
作者贡献:徐英春牵头制订共识框架,组建共识制订工作组,组织工作组讨论、修订并审阅定稿;胡继红组织工作组复习文献,起草、修订共识并审阅定稿;所有成员参与讨论、修订并形成共识意见;王瑶、何书宇、邹嘉琪对共识进行撰写、修订和审校。利益冲突:所有参与共识制订的人员均声明不存在利益冲突编审组 (按姓氏首字母排序):阿祥仁(青海省人民医院),褚云卓(中国医科大学附属第一医院),多丽波(哈尔滨医科大学附属第二医院),高春海(临沂市人民医院),顾兵(广东省人民医院),郭大文(哈尔滨医科大学附属第一医院),郭鹰(重庆医科大学附属巴南医院),韩崇旭(江苏省苏北人民医院),侯锐钢(山西医科大学第二医院),胡辛兰(福建省立医院),胡云建(北京医院),贾伟(宁夏医科大学总医院),康梅(四川大学华西医院),柯江维(江西省儿童医院),李彬(福建医科大学附属协和医院),李刚(宁夏医科大学总医院),李俊明(南昌大学第一附属医院),廖康(中山大学附属第一医院),林宁(江苏省淮安市第一人民医院),林勇平(广州医科大学附属第一医院),刘文恩(中南大学湘雅医院),刘小平(北京大学深圳医院),刘勇(中国医科大学附属盛京医院),卢志明(山东第一医科大学附属省立医院山东省立医院),罗春华(湖北省宜昌市中心人民医院),罗春玉(赤峰学院附属医院),罗燕萍(中国药师学会),马小军(中国医学科学院北京协和医院),马筱玲(中国科技大学附属第一医院),毛小琴(云南省第一人民医院),木克代斯·米尔地洋(新疆维吾尔自治区人民医院),穆红(天津市第一中心医院),潘艳(江苏省涟水县人民医院),单斌(昆明医科大学第一附属医院),沈瀚(南京大学附属鼓楼医院),沈继录[安徽省公共卫生临床中心安徽医科大学第一附属医院(北区)],王晶(大连医科大学附属第一医院),魏莲花(甘肃省人民医院检验中心),吴洁(中国医学科学院北京协和医院),谢丽(广西医科大学第二附属医院),徐雪松(吉林大学中日联谊医院),杨滨(福建医科大学附属第一医院),杨青(浙江大学医学院附属第一医院),喻华(四川省医学科学院四川省人民医院),张利侠(陕西省人民医院),张义(山东大学齐鲁医院),张樱(解放军总医院第一医学中心),赵建宏(河北医科大学第二医院河北省临床检验中心),周泽奇[丹娜(天津)生物科技股份有限公司],朱镭(山西省儿童医院)外审组 (按姓氏首字母排序):曹东林(广东省第二人民医院),陈浪(北京金沃夫生物工程科技有限公司),戴二黑(石家庄市第五医院),戴俊(广州海关技术中心),段朝晖(中山大学孙逸仙纪念医院),关伟杰(广州医科大学附属第一医院广州呼吸健康研究院),郝晓珂(西安区域医学检验中心),胡凤玉(广州市第八人民医院),李六亿(北京大学第一医院),李一荣(武汉大学中南医院),梁皓钧(香港大学公共卫生学院),马学军(中国疾病预防控制中心病毒病预防控制所),秦晓松(中国医科大学附属盛京医院),苏建荣(首都医科大学附属北京友谊医院),汤一苇(丹纳赫诊断平台/赛沛中国),陶志华(浙江大学医学院附属第二医院),王华梁(上海市实验医学研究院),王云峰(美国亚特兰大格雷迪纪念医院),张国军(首都医科大学附属北京天坛医院),赵锐(北京电力医院),郑磊(南方医科大学南方医院),周海卫(中国食品药品检定研究院),卓超(广州医科大学附属第一医院)秘书组 (按姓氏首字母排序):何书宇(广州万孚生物技术股份有限公司),卢国萍[梅里埃诊断产品(上海)有限公司],汪小芳(广州万孚生物技术股份有限公司),杨文航(中国医学科学院北京协和医院),杨洋(中国医学科学院北京协和医院),张戈(中国医学科学院北京协和医院),邹嘉琪(广州万孚生物技术股份有限公司)执笔人:邹嘉琪(广州万孚生物技术股份有限公司),王瑶(中国医学科学院北京协和医院),康可人(广州万孚生物技术股份有限公司),胡继红(国家老年医学中心中国医学科学院老年医学研究院北京医院),徐英春(中国医学科学院北京协和医院) -
表 1 常用新型冠状病毒抗原快速检测方法及技术特点
检测方法 标记物 技术特点 适用场景 胶体金免疫层析法 胶体金颗粒 优点:无需借助仪器,目视即可判读结果
缺点:可能存在个体主观判断的差异基层医疗卫生机构、隔离观察人员及社区居民自测 乳胶免疫层析法 乳胶微球 荧光免疫层析法 荧光微球 优点:稳定性好、不易受自然光的干扰,敏感性高
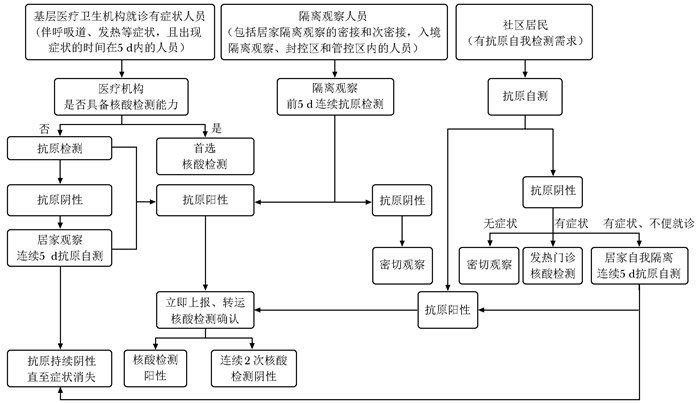
缺点:需免疫分析仪辅助基层医疗卫生机构 临床症状 抗原检测 核酸检测 抗体检测* 结果解读 处置建议 IgM IgG 无症状 - - - - 无感染证据 NA - - - + 已接种疫苗,或既往感染 NA - - + -/+ 疫苗接种早期,或无症状感染者/病毒携带者核酸检测转阴后 (1)无接触史者:自我观察
(2)有接触史者:不排除处于感染潜伏期,按疫情防控政策隔离、医学观察、核酸检测,隔离前5 d连续进行抗原检测+ - -/+ -/+ 感染早期,或抗原非特异性反应 立即进行核酸检测,按疫情防控政策要求进行隔离、医学观察;连续两次核酸检测阴性(至少间隔24 h)可排除疑似病例的诊断 -/+ + -/+ -/+ 无症状感染者或病毒携带者 立即上报,按疫情防控政策要求进行集中隔离、密切医学观察并采取相关措施 有症状 -
-
--
-
--
-
+-
+
-/+检测窗口期,或其他疾病
感染恢复期,或既往感染史,或已接种疫苗,或其他疾病
感染早期,或已接种疫苗,或其他疾病(1)无接触史者:发热门诊就诊、核酸检测,鉴别诊断、对症治疗;不便就诊者居家隔离并连续5 d抗原自测,至抗原持续阴性且症状消失
(2)有接触史者:按疫情防控政策要求进行隔离、核酸检测、鉴别诊断、对症治疗,隔离前5 d连续进行抗原检测+ - -/+ -/+ 感染早期,或其他疾病发生抗原非特异性反应 立即进行核酸检测,按疫情防控政策要求进行隔离、鉴别诊断、对症治疗,连续2次核酸阴性(至少间隔24 h)可排除疑似病例诊断 -/+ + -/+ -/+ 确诊病例 立即上报,按疫情防控政策转送定点医院治疗 *排除抗体非特异性交叉反应;NA: 无处置建议 -
[1] 国家卫生健康委员会办公厅, 国家中医药管理局办公室. 关于印发新型冠状病毒肺炎诊疗方案(试行第九版)的通知(国卫办医函〔2022〕71号)[EB/OL]. (2022-03-14)[2022-04-10]. http://www.gov.cn/zhengce/zhengceku/2022-03/15/content_5679257.htm. [2] 国务院应对新型冠状病毒肺炎疫情联防联控机制综合组. 关于印发新冠病毒抗原检测应用方案(试行)的通知(联防联控机制综发〔2022〕21号)[EB/OL]. (2022-03-11)[2022-04-10]. http://www.nhc.gov.cn/yzygj/s7659/202203/d4d7fb72088447f7a4f9cd10966a67eb.shtml. [3] 医政医管局. 新冠病毒抗原检测应用方案(试行)政策解读[EB/OL]. (2022-03-11)[2022-04-10]. http://www.nhc.gov.cn/yzygj/s7659/202203/4573dfb9cca244509c29b964ba287889.shtml. [4] 国家药品监督管理局. 医疗器械数据查询[EB/OL]. (2022-04-07) [2022-04-10]. https://www.nmpa.gov.cn/datasearch/search-result.html. [5] World Health Organization. WHO Emergency Use Listing for in vitro diagnostics (IVDs) detecting SARS-CoV-2[EB/OL]. (2022-02-23)[2022-04-10]. https://extranet.who.int/pqweb/sites/default/files/documents/220223_EUL_SARS-CoV-2_product_list.pdf.
[6] U.S. Food & Drug Administration. In Vitro Diagnostics EUAs-Antigen Diagnostic Tests for SARS-CoV-2[EB/OL]. (2022-04-07)[2022-04-10]. https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/in-vitro-diagnostics-euas-anti-gen-diagnostic-tests-sars-cov-2.
[7] European Commission Directorate-General for Health and Food Safety. EU health preparedness: A common list of COVID-19 rapid antigen tests; A common standardised set of data to be included in COVID-19 test result certificates; and A common list of COVID-19 laboratory based antigenic assays[EB/OL]. (2022-03-30)[2022-04-10]. https://ec.europa.eu/health/system/files/2022-03/covid-19_rat_common-list_en_1.pdf.
[8] 范曼如, 申泉, 王丹琦, 等. 临床实践指南制订方法: 形成推荐意见的共识方法学[J]. 中国循证心血管医学杂志, 2019, 11: 647-653. DOI: 10.3969/j.issn.1674-4055.2019.06.02 [9] 北京协和医院罕见病多学科协作组, 中国罕见病联盟. 多准则决策分析应用于罕见病药品临床综合评价的专家共识(2022)[J]. 协和医学杂志, 2022, 13: 126-145. https://www.cnki.com.cn/Article/CJFDTOTAL-XHYX202202010.htm [10] Kandimalla R, John A, Abburi C, et al. Current Status of Multiple Drug Molecules, and Vaccines: An Update in SARS-CoV-2 Therapeutics[J]. Mol Neurobiol, 2020, 57: 4106-4116. DOI: 10.1007/s12035-020-02022-0
[11] Zandi M, Soltani S. Hemagglutinin-esterase cannot be considered as a candidate for designing drug against COVID-19[J]. Mol Divers, 2021, 25: 1999-2000. DOI: 10.1007/s11030-021-10272-w
[12] Scheiblauer H, Filomena A, Nitsche A, et al. Comparative sensitivity evaluation for 122 CE-marked rapid diagnostic tests for SARS-CoV-2 antigen, Germany, September 2020 to April 2021[J]. Euro Surveill, 2021, 26: 2100441.
[13] Peng Y, Du N, Lei Y, et al. Structures of the SARS-CoV-2 nucleocapsid and their perspectives for drug design[J]. EMBO J, 2020, 39: e105938.
[14] 世界卫生组织. 抗原检测用于诊断SARS-CoV-2感染: 临时指导文件[EB/OL]. (2021-10-06)[2022-04-10]. https://apps.who.int/iris/bitstream/handle/10665/345948/WHO-2019-nCoV-Antigen-Detection-2021.1-chi.pdf. [15] 刘巨钊, 杨玉萍, 徐建波, 等. 新冠病毒S蛋白RBD突变侵染性增强潜在分子作用机制[J/OL]. 生物学杂志, 2022: 1-8. [2022-04-09]. http://kns.cnki.net/kcms/detail/34.1081.q.20220321.1514.002.html. [16] 徐本锦, 范蕾, 杜淼, 等. 新冠病毒核衣壳蛋白结构与功能的生物信息学分析及原核表达[J/OL]. 中国免疫学杂志, 2021: 1-25. http://kns.cnki.net/kcms/detail/22.1126.R.20210924.0101.002.html. [17] Bates TA, Weinstein JB, Farley S, et al. Cross-reactivity of SARS-CoV structural protein antibodies against SARS-CoV-2[J]. Cell Rep, 2021, 34: 108737. DOI: 10.1016/j.celrep.2021.108737
[18] Corman VM, Haage VC, Bleicker T, et al. Comparison of seven commercial SARS-CoV-2 rapid point-of-care antigen tests: a single-centre laboratory evaluation study[J]. Lancet Microbe, 2021, 2: e311-e319. DOI: 10.1016/S2666-5247(21)00056-2
[19] Seo G, Lee G, Kim MJ, et al. Rapid Detection of COVID-19 Causative Virus (SARS-CoV-2) in Human Nasopharyn-geal Swab Specimens Using Field-Effect Transistor-Based Biosensor[J]. ACS Nano, 2020, 14: 5135-5142. DOI: 10.1021/acsnano.0c02823
[20] Mahari S, Roberts A, Shahdeo D, et al. eCovSens-Ultrasensitive Novel In-House Built Printed Circuit Board Based Electrochemical Device for Rapid Detection of nCovid-19 antigen, a spike protein domain 1 of SARS-CoV-2[J]. bioRxiv, 2020. doi: 10.1101/2020.04.24.059204.
[21] Dinnes J, Deeks JJ, Berhane S, et al. Rapid, point-of-care antigen and molecular-based tests for diagnosis of SARS-CoV-2 infection[J]. Cochrane Database Syst Rev, 2021, 3: CD013705.
[22] Bruzzone B, De Pace V, Caligiuri P, et al. Comparative diagnostic performance of rapid antigen detection tests for COVID-19 in a hospital setting[J]. Int J Infect Dis, 2021, 107: 215-218. DOI: 10.1016/j.ijid.2021.04.072
[23] Chaimayo C, Kaewnaphan B, Tanlieng N, et al. Rapid SARS-CoV-2 antigen detection assay in comparison with real-time RT-PCR assay for laboratory diagnosis of COVID-19 in Thailand[J]. Virol J, 2020, 17: 177. DOI: 10.1186/s12985-020-01452-5
[24] Brümmer LE, Katzenschlager S, Gaeddert M, et al. Accur-acy of novel antigen rapid diagnostics for SARS-CoV-2: A living systematic review and meta-analysis[J]. PLoS Med, 2021, 18: e1003735. DOI: 10.1371/journal.pmed.1003735
[25] Smith RL, Gibson LL, Martinez PP, et al. Longitudinal Assessment of Diagnostic Test Performance Over the Course of Acute SARS-CoV-2 Infection[J]. J Infect Dis, 2021, 224: 976-982. DOI: 10.1093/infdis/jiab337
[26] Khalid MF, Selvam K, Jeffry A, et al. Performance of Rapid Antigen Tests for COVID-19 Diagnosis: A Systematic Review and Meta-Analysis[J]. Diagnostics (Basel), 2022, 12: 110. DOI: 10.3390/diagnostics12010110
[27] Deng Q, Ye G, Pan Y, et al. High Performance of SARS-Cov-2N Protein Antigen Chemiluminescence Immunoassay as Frontline Testing for Acute Phase COVID-19 Diagnosis: A Retrospective Cohort Study[J]. Front Med (Lausanne), 2021, 8: 676560.
[28] Yokoyama R, Kurano M, Nakano Y, et al. Association of the Serum Levels of the Nucleocapsid Antigen of SARS-CoV-2 With the Diagnosis, Disease Severity, and Antibody Titers in Patients With COVID-19: A Retrospective Cross-Sectional Study[J]. Front Microbiol, 2021, 12: 791489. DOI: 10.3389/fmicb.2021.791489
[29] European Centre for Disease Prevention and Control. Options for the use of rapid antigen tests for COVID-19 in the EU/EEA-first update[EB/OL]. (2021-10-26)[2022-04-09]. https://www.ecdc.europa.eu/en/publications-data/options-use-rapid-antigen-tests-covid-19-eueea-first-update.
[30] Jungnick S, Hobmaier B, Mautner L, et al. Detection of the new SARS-CoV-2 variants of concern B. 1.1.7 and B. 1.351 in five SARS-CoV-2 rapid antigen tests (RATs), Germany, March 2021[J]. Euro Surveill, 2021, 26: 2100413.
[31] Pulliam J, van Schalkwyk C, Govender N, et al. Increased risk of SARS-CoV-2 reinfection associated with emergence of Omicron in South Africa[J]. Science, 2022, 376: eabn4947. DOI: 10.1126/science.abn4947
[32] Saxena SK, Kumar S, Ansari S, et al. Characterization of the novel SARS-CoV-2 Omicron (B. 1.1.529) variant of concern and its global perspective[J]. J Med Virol, 2022, 94: 1738-1744. DOI: 10.1002/jmv.27524
[33] Soni A, Herbert C, Filippaios A, et al. Comparison of Rapid Antigen Tests' Performance between Delta (B. 1.61.7; AY. X) and Omicron (B. 1.1.529; BA1) Variants of SARS-CoV-2: Secondary Analysis from a Serial Home Self-Testing Study[J]. medRxiv, 2022. doi: 10.1101/2022.02.27.22271090.
[34] Bekliz M, Perez-Rodriguez F, Puhach O, et al. Sensitivity of SARS-CoV-2 antigen-detecting rapid tests for Omicron variant[J]. medRxiv, 2021. doi: https://www.medrxiv.org/content/10.1101/2021.12.18.21268018.
[35] Deerain J, Druce J, Tran T, et al. Assessment of the Analytical Sensitivity of 10 Lateral Flow Devices against the SARS-CoV-2 Omicron Variant[J]. J Clin Microbiol, 2022, 60: e247921.
[36] Bullard J, Dust K, Funk D, et al. Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples[J]. Clin Infect Dis, 2020, 71: 2663-2666. DOI: 10.1093/cid/ciaa638
[37] U.S. FOOD & DRUG ADMINISTRATION. Potential for False Positive Results with Antigen Tests for Rapid Detection of SARS-CoV-2-Letter to Clinical Laboratory Staff and Health Care Providers[EB/OL]. (2020-11-03)[2022-04-10]. https://www.fda.gov/medical-devices/letters-health-care-providers/potential-false-positive-results-antigen-tests-rapid-detection-sars-cov-2-letter-clinical-laboratory.
[38] Mouliou DS, Gourgoulianis KI. False-positive and false-negative COVID-19 cases: respiratory prevention and management strategies, vaccination, and further perspectives[J]. Expert Rev Respir Med, 2021, 15(8): 993-1002. DOI: 10.1080/17476348.2021.1917389
[39] Larremore DB, Wilder B, Lester E, et al. Test sensitivity is secondary to frequency and turnaround time for COVID-19 screening[J]. Sci Adv, 2021, 7: eabd5393. DOI: 10.1126/sciadv.abd5393
[40] Mina MJ, Parker R, Larremore DB. Rethinking Covid-19 Test Sensitivity-A Strategy for Containment[J]. N Engl J Med, 2020, 38: e120.
[41] 国务院应对新型冠状病毒肺炎疫情联防联控机制综合组. 基层医疗卫生机构新冠病毒抗原检测基本要求及流程[EB/OL]. (2022-03-10)[2022-04-10]. http://www.nhc.gov.cn/yzygj/s7659/202203/d4d7fb72088447f7a4f9cd10966a67eb/files/b62d9eeeca8242b3a22e78a25ef9fd92.pdf. [42] 中国合格评定国家认可委员会. 2019临床免疫学定性检验程序性能验证指南: CNAS-GL038[S]. 2019. [43] 国务院应对新型冠状病毒肺炎疫情联防联控机制综合组. 新冠病毒抗原自测基本要求及流程[EB/OL]. (2022-03-10)[2022-04-10]. http://www.nhc.gov.cn/yzygj/s7659/202203/d4d7fb72088447f7a4f9cd10966a67eb/files/8db5dd22ccb84b6296bc4257ba7db9c0.pdf. [44] Stohr J, Zwart VF, Goderski G, et al. Self-testing for the detection of SARS-CoV-2 infection with rapid antigen tests for people with suspected COVID-19 in the community[J]. Clin Microbiol Infect, 2021, S1198-743X(21)00434-1. doi: 10.1016/j.cmi.2021.07.039.
[45] Maya S, Kahn JG. Cost-effectiveness of antigen testing for ending COVID-19 isolation[J]. medRxiv, 2022, 2022.03.21.22272687. doi: 10.1101/2022.03.21.22272687.
[46] 交通运输部, 外交部, 海关总署. 关于做好国际航行船舶船员新冠肺炎疫情远端防控的公告(交通运输部公告2022年第14号)[EB/OL]. (2022-01-28)[2022-04-10]. http://www.gov.cn/zhengce/zhengceku/2022-02/13/content_5673345.htm. [47] 天津市卫生健康委员会. 市卫生健康委转发市防控指挥部关于印发天津市新冠病毒抗原检测应用阶段性实施方案(试行)的通知(津卫医政〔2022〕151号)[EB/OL]. (2022-03-29)[2022-04-10]. http://wsjk.tj.gov.cn/ZWGK3158/ZCFG6243_1/GZWJ625/202203/t20220329_5842885.html. -
期刊类型引用(3)
1. 荆舒,戴振威,苏小游,李峥. 群医学理念在护理实践中的应用及启示. 中华护理杂志. 2025(04): 493-499 .  百度学术
百度学术
2. 张祎冰,黄鹏. BOPPPS教学模式结合雨课堂在眼科临床见习中的应用. 医学研究杂志. 2024(09): 188-191 .  百度学术
百度学术
3. 董樑,汪天翔,薛蔚,丁强. “4+4”临床医学培养模式中开展医工交叉的思考. 上海医学. 2024(08): 466-469 .  百度学术
百度学术
其他类型引用(0)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS


 下载:
下载: