Difference in Clinicopathological Features of Triple Negative Breast Cancer and Non-triple Negative Breast Cancer and Relationship between Clinicopathological Features and Expressions of Estrogen Receptor β/Epidermal Growth Factor Receptor
-
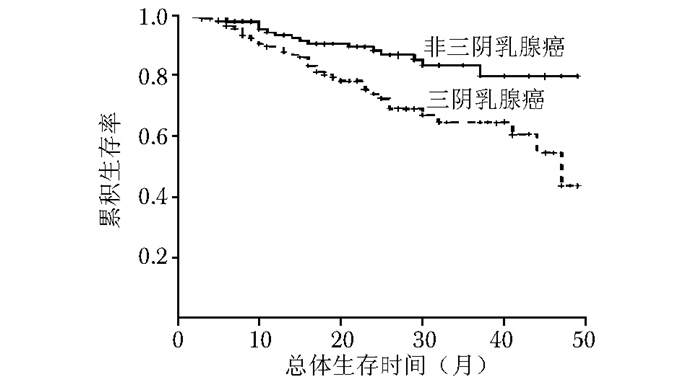
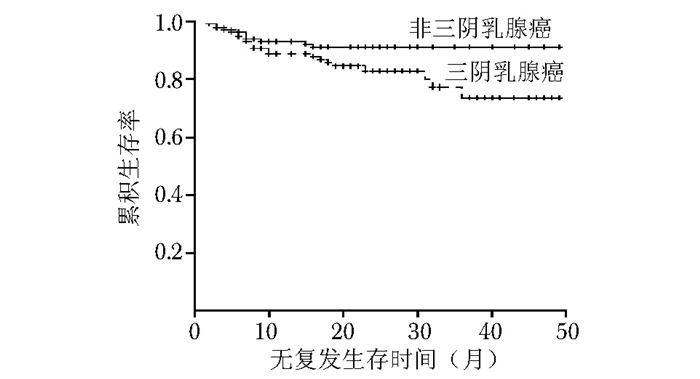
摘要:目的 比较三阴乳腺癌与非三阴乳腺癌在临床病理特征及部分免疫组织化学指标表达上的差异, 并探讨这些免疫组织化学指标的表达与三阴乳腺癌临床病理特征及预后的关系。方法 2010年1月至2013年12月北京协和医院收治的经组织病理确诊的乳腺癌患者共863例, 其中三阴乳腺癌患者135例, 非三阴乳腺癌患者728例。分析三阴乳腺癌与非三阴乳腺癌患者在发病年龄、病理类型、肿瘤大小、分化程度、肿瘤分期、是否有淋巴结转移、是否累及乳头以及手术方式等临床病理特征方面的差异。通过免疫组织化学法检测135例三阴乳腺癌患者与经单纯抽样法选取的135例非三阴乳腺癌患者中雌激素受体β(estrogen receptor β, ERβ)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、P53、Ki67的表达, 分析上述指标在两类乳腺癌中的表达差异。进一步通过单因素生存分析探讨三阴乳腺癌患者的预后相关因素。结果 三阴乳腺癌中浸润性导管癌的比例高于非三阴乳腺癌(86.7%比65.2%, P < 0.001), 发病年龄低于非三阴乳腺癌[(46.0±10.6)岁比(51.0±13.3)岁, P < 0.05];三阴乳腺癌与非三阴乳腺癌在淋巴结转移、临床分期、肿瘤大小、分化程度、手术方式方面差异亦有统计学意义(P < 0.05);三阴乳腺癌与非三阴乳腺癌在肿瘤累及乳头的比例差异无统计学意义(P > 0.05)。免疫组织化学结果显示, 三阴乳腺癌中ERβ阳性表达率较非三阴乳腺癌显著降低(63.7%比75.6%, P < 0.05), 而EGFR阳性表达率显著升高(62.2%比33.3%, P < 0.05);P53、Ki67在三阴乳腺癌与非三阴乳腺癌中的表达差异无统计学意义(P > 0.05)。与非三阴乳腺癌相比, 三阴乳腺癌的总体生存率(overall survival, OS)和无复发生存率(relapse-free survival, RFS)更低(P < 0.05)。三阴乳腺癌单因素生存分析结果显示, ERβ阴性表达与EGFR阳性表达均与三阴乳腺癌的不良预后相关(P < 0.05)。结论 相较于非三阴乳腺癌, 三阴乳腺癌有明显不同的临床病理特征:发病年龄较低、原发肿瘤体积较大、分化程度低、易发生淋巴结转移、ERβ阳性表达率较低、EGFR阳性表达率较高、OS及RFS较低。ERβ和EGFR可能成为重要的三阴乳腺癌预后判断指标。Abstract:Objective To analyze the differences in clinicopathologic features and expressions of some immunohistochemical indicators between triple negative breast cancer and non-triple negative breast cancer, and to investigate the relationship between clinicopathological features and immunohistochemical indicators.Methods A total of 863 patients (135 triple negative breast cancer and 728 non-triple negative breast cancer) with histopathologically confirmed breast cancer were collected in Peking Union Medical College Hospital from January 2010 to December 2013.We retrospectively analyzed the difference in the onset age, histological subtype, tumor size, tumor differentiation, tumor stages, lymph node metastasis, nipple involvement and operation method between triple negative breast cancer and non-triple negative breast cancer, then explored the difference between them in the expressions of estrogen receptor β (ERβ), epidermal growth factor receptor (EGFR), P53, and Ki67 by immunohistochemical staining. Prognostic factors of triple negative breast cancer were further discussed by univariate survival analysis.Results The proportion of invasive ductal carcinoma in triple negative breast cancer was higher than that in non-triple negative breast cancer (86.7% vs. 65.2%, P < 0.001); the age of onset was younger in triple negative breast cancer[(46.0±10.6) years vs. (51.0±3.3) years, P < 0.05];significant differences were also found in lymph node metastasis, tumor size, differentiation grade, surgical procedure, and tumor stages between the two groups(P < 0.05); no statistically significant inter-group difference in nipple involvement (P > 0.05). Immunohistochemical results showed that compared with non-triple negative breast cancer, ERβ expression rate decreased significantly(63.7% vs. 75.6%, P < 0.05)while EGFR expression rate increased significantly in triple negative breast cancer(62.2% vs. 33.3%, P < 0.05); the expression of P53 and Ki67 demonstrated no significant difference(P > 0.05). The overall survival(OS)and relapse-free survival(RFS)were both lower in triple negative breast cancer(P < 0.05). Univariate survival analysis showed that both ERβ negative expression and EGFR positive expression were related to the poor prognosis of triple negative breast cancer (P < 0.05).Conclusions Compared with non-triple negative breast cancer, triple negative breast cancer shows completely different clinicopathological features:younger age of onset, larger tumor size, lower degree of differentiation, higher incidence of lymph node metastasis, lower ERβ expression, higher EGFR expression, and lower OS and RFS.ERβ and EGFR may be important prognostic indicators in triple negative breast cancer.
-
在临床生物化学(下文简称“生化”)领域,Folin-Wu法(又称“福林-吴宪法”)是血糖测定的经典方法之一。该方法于1920年问世,由美国生化学家奥托·福林(Otto Folin)和我国生化学家吴宪联合发明。科学界普遍认为该方法是吴宪早年间的代表性研究成果,亦是我国科学家在世界生化史上的杰出贡献之一[1]。医学界、医学史学界有关吴宪和生化史的研究中常提及这一方法的重大意义[2-8]。但关于Folin-Wu法发明的具体历史过程、当时学术界给出的评价和反馈以及身为福林博士生的吴宪在这一研究中的学术贡献,目前尚无系统考证资料可循。
考虑到Folin-Wu法的影响力和吴宪在中国医学界的学术地位,笔者认为,对Folin-Wu法的历史进行研究很有必要。通过查阅福林、吴宪等人的原始论文及相关史料,本文梳理了Folin-Wu法的发明和完善过程,以及当时学界围绕其产生的学术争论,希望能够以此为例探讨科学家良性竞争合作对学术发展的影响。此外,笔者亦希望能够在史料研究的基础上,客观评价Folin-Wu法的影响和吴宪在此方法发明过程中的学术贡献,丰富相关医学史研究。
1. Folin-Wu法诞生的背景
1.1 血糖和尿糖测定简史
早在公元前1500年前后,埃及的医学文献中即对糖尿病有所记载[9]。后世医生对糖尿病的症状有许多描述,记录了患者尿液尝起来发甜、能够吸引蚂蚁等现象。17世纪,英国医生托马斯·威利斯(Thomas Willis)推测,糖尿病患者尿中的糖最初来源于血液[10]。18世纪,英国医生马修·多布森(Matthew Dobson)对糖尿病患者的血液和尿液进行了检测,发现糖尿病患者尿液蒸馏后会有糖存留,并确定尿中的糖来自血液[11]。虽然许多医学家怀疑糖尿病患者的血糖和尿糖升高,但由于不了解这种糖的化学结构,一直无法进行测定。直至1815年,法国化学家米歇尔·谢弗勒尔(Michel Chevreul)从糖尿病患者的尿中分离出糖,并指出其化学性状类似于葡萄糖,才为后来的生化检测奠定了基础[12]。1841年,德国化学家埃尔哈德·米切利希(Eilhard Mitscherlich)发现,将含有氢氧化钠和硫酸铜的溶液与尿液共同加热至沸腾,若尿液中含有还原性物质(如葡萄糖、乳糖、果糖等),就会生成淡黄色或淡红色沉淀[13]。1848年,德国化学家赫尔曼·冯·斐林(Hermann von Fehling)在此基础上设计出由氢氧化钠、硫酸铜和酒石酸钾钠配制而成的试剂(后称“斐林试剂”),用于检测尿液中的葡萄糖[13]。19世纪末,数位生化学家先后提出了适于实验室开展的血糖测定方法,其原理大多与斐林的实验类似(基于对还原性物质的检测推测血糖含量),但所需血量较大,定量测量的准确性也有限[14]。
1908年,年仅24岁的美国生化学家斯坦利·本尼迪克特(Stanley Benedict)在斐林试剂的基础上设计出了一种新的尿糖检测试剂,即现在为医学生所熟知的“本尼迪克特试剂”,其中包含硫酸铜、柠檬酸钠和碳酸钠。本尼迪克特指出,碳酸盐对葡萄糖的破坏性明显小于斐林试剂中的氢氧化铜试剂[6]。这种方法的原理依然是还原性物质检测,但对尿中葡萄糖含量测定的敏感性显著高于其他方法,因此成为当时临床检测中应用最广的方法[13]。
20世纪初,糖尿病的临床治疗尚无有效办法,主要依靠饮食限制。医生们迫切需要一种便捷的血糖测定方法以了解患者的血糖情况。1913年,美国著名糖尿病学家弗雷德里克·艾伦(Frederick Allen)在《关于糖尿和糖尿病的研究》(Studies Concerning Glycosuria and Diabetes)一书中呼吁,“在临床实践中,需要一种快速、准确的血糖测定方法。”[15]正是在这样的历史背景下,美国生化学界颇有声名的福林和本尼迪克特都投身到了血糖检测方法的研究之中。而二者的学术竞争,不仅成为他们科研生涯中的一个重要主题,也间接推动了Folin-Wu法的诞生和完善。
1.2 福林与本尼迪克特的竞争
福林是20世纪美国生化学史上最著名的生化学家之一,也被称为美国第一个临床生化学家。他1867年出生在瑞典南部,1892年获得明尼苏达大学学位后,进入芝加哥大学攻读有机化学专业的研究生。此时欧洲的生理化学(physiological chemistry)领域正蓬勃发展,福林决定前往欧洲学习此方面的知识。1897—1898年,福林先后跟随德国生化学家恩斯特·萨尔科夫斯(Ernst Salkowski)、阿尔布雷希特·科塞尔(Albrecht Kossel)学习。他在德国了解了用于酿酒业的比色新技术,掌握了最新版比色计的用法,这成为其后来设计生化检测中比色方法的基础。1898年,福林返回芝加哥并获得了博士学位。1904年,福林就职于麦克莱恩医院(McLean Hospital)期间,提出可使用简单比色法(simple colorimetric method)定量测定尿液中肌酐的含量。他利用尿肌酐与碱性环境中的苦味酸离子在室温下反应变红的性质,将尿肌酐的量与红色的深浅建立相关性,再用比色计比较颜色的深浅度,从而得出较为准确的定量结果。将比色计应用于尿肌酐定量分析这一举措,极大地推进了临床血液生化检测方法的发展[3]。1905年,福林在《美国生理学杂志》(Am J Physiol)接连发表3篇论文,描述了尿液中尿素、氨、肌酸、肌酐和尿酸的分析方法,这些文章及其中分析方法的日益普及为福林赢得了巨大学术声誉[16]。1907年,他被哈佛大学任命为生化系教授,并于1909年成为系主任[3]。
20世纪初期,临床糖尿病学家呼吁发明更快速准确的血糖测定法[17]。同时,福林也意识到尿液分析的局限性——在人体新陈代谢研究领域,与其研究经肾脏排泄出的代谢产物,不如直接研究血液中的生化成分。他随后改进了用来定量测量尿肌酐的比色法,使其适用于血液中各项生化指标的检测。1914年,福林首次公开发表此种分析方法,得到了广泛好评[18]。
但彼时身为康奈尔大学医学院生化教授的本尼迪克特却对福林的方法提出了批评。本尼迪克特发现,当应用福林的比色法测定尿液中的尿素含量时,随着尿素分解成氨和二氧化碳,一些肌酐和尿酸也发生了分解,生成相同的产物。这证明,以福林方法测得的尿素值高于实际尿素值。本尼迪克特对此进行了深入研究,设计出了一种特异性更强的检测方法,使测得的尿素含量更接近真实值。接下来的几年里,每当福林研究出一种分析方法,本尼迪克特就会对其研究进行审视和批判,在一些重要细节上进行改进[18]。
同样,福林也在不断批评本尼迪克特的方法。本尼迪克特在1908年改进的铜还原法是20世纪初应用最广泛的尿糖定量检测方法,但缺陷为尿液中存在干扰葡萄糖定量检测的物质,此类物质可促进铜还原,使实验结果偏高[6]。当时许多生化学家都想解决这一问题,剔除这类物质的干扰,降低测定结果,福林也不例外。1915年,福林发表了1篇关于尿糖含量测定的论文,指出本尼迪克特的方法及当时其他方法的准确度均不够高,并提出引入苦味酸来沉淀尿中存在的肌酐等还原性物质,该法不仅可减少对碱性铜试剂的还原作用,敏感度亦明显提升[19]。
就在福林提出引入苦味酸的同时,本尼迪克特也决定应用苦味酸法测定血糖。1913年,本尼迪克特和生化学家罗伯特·刘易斯(Robert Lewis)共同发表了1篇使用苦味酸法估算少量血液中血糖含量的论文。文章指出,当葡萄糖与苦味酸、碳酸钠共热时溶液变红,可利用此显色反应进行比色,从而估计血液中葡萄糖的含量。随后几年,本尼迪克特及其团队在此基础上不断改进,发表了以改进版苦味酸法测定血糖和尿糖的一系列论文[6]。
福林对血糖测定的探索也未曾停止。早在1912年,他阅读了1篇以磷钨和磷钼酸化合物作为显色剂的论文,便以此为基础开启了进一步研究[20]。同年,福林及其助手、美国生化学家威利·丹尼丝(Willey Denis)共同研制出了一种Folin-Denis试剂。该试剂由钨酸钠、磷钼酸、磷酸组成,用于测量血液中的非蛋白含氮物质[20]。在考察本尼迪克特的苦味酸测血糖法研究之后,福林思考:能否在此基础上,再作一些改进呢?正是该研究思路,催生了Folin-Wu法。
2. Folin-Wu法的发明
福林把改进本尼迪克特苦味酸测血糖法的研究任务指派给了自己的博士研究生吴宪。吴宪出生于中国福州的一个书香门第。1911年,他怀揣着投身中国海军的梦想,远赴重洋,进入麻省理工学院学习造船工程。机缘巧合之下,他阅读了托马斯·赫胥黎(Thomas Huxley)的《生命的物质基础》(On the Physical Basis of Life)等一系列论文,遂对生命科学产生兴趣,于是转而攻读化学和生物学。1916年获得学士学位后,他考入哈佛大学医学院,进入福林的实验室,开始对血糖测定进行研究[7]。
吴宪和福林最初的想法是对本尼迪克特的苦味酸盐测血糖法作一些改进,但在多次实验后却发现Folin-Denis试剂与苯酚混合后,可与氧化亚铜发生强烈而稳定的显色反应,这远比通过苦味酸反应得到的颜色明显。而用于还原的溶液,是一种对微量糖极为敏感的碱性酒石酸铜试剂(由碳酸钠、酒石酸和硫酸铜组成),不受肌酸或尿酸的影响。除此之外,为了进一步提高测量的准确度,福林与吴宪还研制出了一种钨酸滤血法来沉淀血液中的蛋白质。此过程无须加热,也不存在过量酸的加入,可产生接近于中性的滤液。如此,便可排除血液中的蛋白对试剂氧化还原反应的干扰,从而降低测量误差。这种滤过血液中蛋白质的方法是临床生化研究发展的里程碑,其不仅可用于血糖测定,还可广泛应用于血液中肌酐、尿酸、非蛋白氮和氯化物等的测定[3]。福林和吴宪把自己的检测结果和苦味酸法测得的数值进行比较,认为“相较于现存的测血糖法,我们的方法最为准确”[21]。
1919年,该研究成果发表于《生物化学杂志》(J Biol Chem),其中对血糖含量的测定方法,便是Folin-Wu法的雏形。而文章中呈现的丰富、精确的研究细节,也被后世学者视为福林生化研究风格的典型代表[16]。
本尼迪克特密切关注着福林和吴宪的研究进展。二人的文章发表后不久,美国生化学家协会年会召开。在此次会议上,本尼迪克特公开指出了Folin-Wu法的缺陷,“这种方法存在大量的、不可避免且不可控制的亚铜再氧化”,即在实验的过程中,铜离子被葡萄糖还原所生成的亚铜离子又会被空气中的氧气重新氧化成铜离子,使实际测得的亚铜离子量变少,导致血糖测定值不准确[6]。
吴宪立刻着手解决本尼迪克特提出的问题。考虑到导师福林与本尼迪克特学术上的争端,他在研究出确切的改进方法前并未告诉福林,直到独立完成改进工作后才向福林汇报[7]。1920年,吴宪和福林在《生物化学杂志》上再次发文,文中对本尼迪克特的批评作出了详细回应。首先,他们承认在实验过程中的确存在亚铜再氧化现象,但指出该问题所造成的误差并不会太大。其次,针对再氧化问题,他们设计出了一种特殊试管(图 1),即Folin-Wu式血糖管,以最大程度降低亚铜再氧化的发生,这种试管至今仍在生化实验中使用。他们还在文章中写道,“我们很感谢本尼迪克特先生,因为有您,我们得以重新审视自己的研究方法。”[22]
![]() 图 1 1920年的Folin-Wu式血糖管[22]
图 1 1920年的Folin-Wu式血糖管[22]同时,吴宪还独立提出了Folin-Denis与苯酚混合试剂的改进版本,该试剂由磷酸、钨酸钠和钼酸组成,可在酸性环境下与亚铜离子反应[7]。原试剂中由于碱性酒石酸铜显蓝色,而酚试剂显黄色,在进行比色定量时会影响实验结果。但新试剂为比色反应提供了弱酸性环境,无酒石酸铜(碱性)生成,且无酚类物质参与反应,故误差减小[22]。这使得Folin-Wu法得到了进一步完善,测得的血糖值更加准确。
1925年,本尼迪克特对改进后的Folin-Wu法又提出了新的批评。他提出了一种改良版的铜还原测血糖法——在碱性铜试剂中加入亚硫酸氢钠。当用此法测定血糖时,得到的结果数值明显低于Folin-Wu法,“新方法测得的数据始终是Folin-Wu法的1/3左右”,也就是说比Folin-Wu法更准确[6]。此外,本尼迪克特还批评了Folin-Wu式血糖管。他认为,可用普通的试管代替Folin-Wu式血糖管,只需用惰性气体取代试管内的空气,并用棉塞封闭试管口就可以得到同样的效果[23]。
1926年,福林发表了《测定血液和正常尿液中糖含量》(The Determination of Sugar in Blood and in Normal Urine)一文,该文对Folin-Wu法的碱性酒石酸铜试剂改进方法进行描述,并反驳了本尼迪克特的看法。福林指出,“铜试剂中碳酸钠的存在给铜还原反应营造了一种过强的碱性环境”,且葡萄糖在碱性溶液中性质不稳定,会与碱性试剂缓慢发生反应,由此他在原始试剂的基础上加入了碱性更弱的碳酸氢钠,组成了一种新型的弱碱性酒石酸铜试剂。这种测试方法的适用范围很广,可用来测定血糖和尿糖[24]。同时,文章中提到,他重复了本尼迪克特的实验,认为没有证据能证明本尼迪克特新方法测得的血糖值低于Folin-Wu法,且本尼迪克特改进时使用的亚硫酸氢盐性质不稳定,会自发氧化成硫酸盐[24]。而关于Folin-Wu式血糖管,福林写道,“我们试验过本尼迪克特提出的方法,但并没有效果,因此才设计出了Folin-Wu式血糖管。”[24]
面对福林的回应,本尼迪克特承认亚硫酸氢盐的不稳定性,他表示,“很抱歉在这点上犯错误”,但接着又指出了福林这篇新文章中的错误——改良版铜试剂无法用于测定尿糖含量。本尼迪克特将定量的葡萄糖加入尿液中,并应用福林改进后的Folin-Wu法测定尿糖,“添加的40 mg葡萄糖中损失了约25%。显然,改进后的Folin-Wu法不适用于尿液中糖含量的测定。”福林也最终屈服并接受了本尼迪克特的批评,认可“以此种方法测量尿糖含量误差很大。”[6]
至此,福林和本尼迪克特围绕测血糖法持续了近10年的争论终于落下帷幕。在双方不断的切磋交流中,Folin-Wu法也在不断完善(表 1),成为了如今我们熟知的血糖测定方法。
表 1 Folin-Wu法的主要试剂及改进过程年份(年) 主要试剂及实验步骤 本尼迪克特的批评 改进方法及优点 改进方法的主要提出者 1919 ①钨酸钠溶液+血液——滤除血液中的蛋白质
②碱性铜试剂(碳酸钠、酒石酸和硫酸铜)——发生铜还原反应
③Folin-Denis试剂(钨酸钠、磷钼酸、磷酸)与苯酚混合——比色定量实验过程中存在亚铜再氧化 ①引入Folin-Wu式血糖管,避免亚铜再氧化
②改良版比色试剂,提高比色准确性吴宪 1920 ①钨酸钠溶液+血液——滤除血液中的蛋白质
②碱性铜试剂(碳酸钠、酒石酸和硫酸铜)——发生铜还原反应
③改良版试剂(磷酸,钨酸钠和钼酸)——比色定量
④反应在Folin-Wu式血糖管内进行测量准确率较低 提高测量的准确性:改良版的铜试剂——为葡萄糖和铜离子反应提供更稳定的环境 福林 1926 ①钨酸钠溶液+血液——滤除血液中的蛋白质
②改良版碱性铜试剂(碳酸氢钠、酒石酸和硫酸铜)——发生铜还原反应
③改良版试剂(磷酸,钨酸钠和钼酸)——比色定量
④反应在Folin-Wu式血糖管内进行无法测定尿糖 - - 3. Folin-Wu法的影响
此前,学术界和大众媒体评价Folin-Wu法时,经常引用生化学家汪猷的说法:“学术界认为,如果没有吴宪先生的血糖测定方法,胰岛素的发现就会受到阻碍。”[25]笔者对史料的考察基本佐证了这一观点,并补充了一些细节。Folin-Wu法对当时学界产生的最大影响,体现在如下两点。
3.1 钨酸滤血法极大改进了血液生化检测的方法学
Folin-Wu法相较于当时其他测血糖法,尤为突出的优点便是其中钨酸滤血法的提出。利用钨酸沉淀血液中的蛋白质,以此制备无蛋白滤液,便避免了血液中多种蛋白质的存在对实验准确性造成的影响。这对于当时正蓬勃发展的临床血液分析研究来说,是强有力的助推剂[3]。这种滤血方法广泛应用于世界各地的实验室,直至20世纪50年代后期才被自动分析仪所取代[3]。当此法与福林所研究的比色法配合应用时,还可用于检测其他微量代谢产物,这是临床生化发展史上的里程碑事件[4]。此外,福林和来自瑞典隆德大学的哈克文·马尔姆罗斯(Haqvin Malmros)在1929年发表的微量测血糖法(Folin-Malmros法)也是基于这种无蛋白滤液设计出的。这种方法用α-氨基联苯试剂代替碱性硫酸铜和酸性钼酸盐,如此便排除了除葡萄糖外的其他还原物质对实验的影响,极大提高了血糖测量的准确性,也被视为非常优秀的临床测血糖法[26]。
3.2 Folin-Wu法助力了胰岛素的临床试验
胰岛素研发的早期动物实验是由弗雷德里克·班廷(Frederick Banting)和查尔斯·贝斯特(Charles Best)在多伦多大学完成的。在动物实验中,贝斯特负责血糖测定,他采用了迈尔斯-贝利法(Myers-Bailey method)测血糖,这种方法首次发表于1916年,是本尼迪克特和刘易斯于1913年设计出的血糖测定法的改良版本[27]。医史学家迈克尔·布利斯(Michael Bliss)在其著作《胰岛素的发现》(The Discovery of Insulin)一书中对此方法评价道:“这种方法的存在使1919年的动物实验更易进行,跟以前比起来,只需很少量的血液样品,便可测量血糖。”[28]而在胰岛素研究后期,加拿大的生化学家詹姆斯·科利普(James Collip)加入了多伦多大学团队,帮助进一步纯化牛胰岛素提取物。1922年1月,1例糖尿病患儿使用了科利普提纯的牛胰岛素,血糖在24 h内从28.9 mmol/L下降至6.7 mmol/L,尿糖从71 g下降至9 g,酮尿消失[27]。同年2月,6例患者使用了相同的方案进行治疗,临床症状均得到极大改善。整个临床试验期间,采用的血糖测量方法即是当时较为先进的Folin-Wu法[27]。Folin-Wu法仅需少量血液样本,操作步骤简单,推动了临床试验的顺利进行。胰岛素的发现获得了1923年的诺贝尔生理学或医学奖。后来,在班廷的诺贝尔奖演讲中,还特意提到了福林和吴宪[29]。
4. 吴宪在Folin-Wu法研究中的具体贡献
吴宪虽然曾在福林指导下攻读博士学位,但实际上是福林的合作者。他主导设计了极具突破性的钨酸滤血法,且在Folin-Wu法的完善过程中,独立对其进行了一次改进和完善[30]。在加入福林实验室的两年内,吴宪便与福林联名发表了著名的《血液分析系统》一文。该文一经发表,立即引起了生化学界的极大重视,被认为“引起了一场血液化学方面的革命”[7]。从研究贡献来看,吴宪完全匹配得上共同命名的荣誉。与福林齐名的生化学家唐纳德·范·斯莱克(Donald Van Slyke)曾在北京协和医学院与吴宪共事,他在晚年回忆起吴宪时,用了这样一句话来介绍当时还年轻的吴宪:“北京协和医学院的化学教授是吴宪,就是福林-吴宪法的那个吴宪。”[31]
福林和他身边的人也高度赞扬吴宪的工作。福林对学生颇为挑剔,但当看到吴宪的论文时,激动地说“这值得第二个博士学位”[4, 7]。福林夫人也认为,吴宪对福林来讲远不只是学生,她评价他们之间的关系,“不仅是同事,更是朋友”[4]。福林作为20世纪最著名的生化学家之一,一生有无数的学生和合作者。当生化学界回顾临床生化史的时候,吴宪被认为是福林最杰出的合作者之一[3]。
5. 余论
Folin-Wu法是最基础、最重要的临床血液生化检查之一,被广泛用于全世界的临床实验室长达50年之久。直至20世纪60年代,在美国临床化学标准方法(Standard Method of Clinical Chemistry)中“Folin-Wu法”和“Nelson Somogyi法”还被同时推荐[32]。后期,酶作为试剂测定血糖的方法有了迅速发展,“酶法”专一性强,特异性高,结果准确,便于在自动生化分析仪上使用。20世纪90年代末,己糖激酶法逐步替代葡萄糖氧化酶法,成为血糖测定的常用方法[32]。
如今,Folin-Wu法依然是所有医学或生化相关专业学生必学的重要生化实验,在生化史上有无可取代的地位。哈佛大学医学院的约瑟夫·奥布(Joseph Aub)教授曾评价,“Folin-Wu法的诞生为生化代谢研究开启了新的篇章”[30]。《生物化学杂志》百年纪念经典论文中,就包括吴宪和福林于1919年发表的《血液分析系统》一文[16]。
在Folin-Wu法的发现过程中,本尼迪克特与福林之间的学术竞争值得一提。在科研过程中,研究者们可能更关注与自己预设结论相近的实验结果。而学术竞争的存在便可纠正这种由研究者个人认知所造成的偏差。尽管科学家潜意识里可能不愿反驳自己的想法,但他们的竞争对手却乐于为之[33]。正是因为这种学术竞争的存在,促使本尼迪克特以批判性眼光一次次检视Folin-Wu法的准确性,促使福林和吴宪不断探索创新。福林和吴宪的“反击”也不断把本尼迪克特的研究推向新的高度[18]。1932年,由于福林和本尼迪克特在血液和尿液分析领域的杰出贡献,二人均获得了诺贝尔生理学或医学奖提名[34]。
福林和本尼迪克特在学术上的长期争斗不但未造成私人关系的恶化,反而加深了他们对彼此的敬意。福林去世后,本尼迪克特在给朋友的一封信中写道:“福林有着让我十分敬佩的品质,当遇到涉及科学领域的分歧时,他能放下个性和情绪,这在科学研究中是极为罕见的。我认识的所有人中,没有人能如我俩这般在有着激烈学术分歧的同时,还保持着25年不变的亲密友谊。”[35]美国生化学家埃尔默·麦科勒姆(Elmer McCollum)在评价本尼迪克特的科研成果时提到,“本尼迪克特与福林进行科学研究的时段重合且有着相同的研究旨趣。他们彼此促进,学术生涯紧密关联。”[18]
这段医学史的第三位主角吴宪,不仅主导设计了钨酸滤血法,制作出了无蛋白滤液,还在1920年独自改进了Folin-Wu法。由其参与设计的Folin-Wu式血糖管至今仍在生化实验室中使用,而这仅仅是他辉煌学术生涯的开端。1920年,吴宪义无反顾地选择回国,任职于北京协和医学院(图 2),并于1924年成为协和有史以来最年轻的系主任。他在生化领域不断钻研,在营养学领域作出了卓越贡献[7-8]。此外,吴宪还曾指导并参与北京协和医院的临床血糖检测,用自己发明的Folin-Wu法服务患者①。
① 笔者参观北京协和医院第六届病历展所见。
![]() 图 2 吴宪在北京协和医学院的工作照[36]
图 2 吴宪在北京协和医学院的工作照[36]美国的中国史专家詹姆斯·里尔登-安德森(James Reardon-Anderson)将吴宪誉为“中国化学的巨人”,评价道:“毫无疑问,吴宪是20世纪前半叶中国最伟大的化学家,或者说是最伟大的科学家”[7]。吴宪求学和工作过的两所机构以相似的方式纪念着他:哈佛大学医学院设立了一间以“Folin-Wu”命名的研讨室,而北京协和医学院在生化系建系100周年之际,以吴宪的名字命名了新的科研大楼。
对于西方科学界来说,相比于盛名在外的福林,吴宪的名字却显得有些陌生。《临床化学》(Clin Chem)杂志的副主编托马斯·安内斯利(Thomas Annesley)曾为此专门撰写1篇文章介绍吴宪的贡献[5]。正如美国著名生化学家约翰·埃德索尔(John Edsall)所说:“遗憾的是,今天的许多生化学家都不知道吴宪的贡献,他不应该被忘记。”[5]
对吴宪在Folin-Wu法发明中的贡献进行研究、宣传,无疑是必要的,而笔者的这次历史研究正是试图厘清这一段医学史,对这位伟大生化学家的早期工作进行梳理,对其贡献进行审慎评价,希望能够对现有的吴宪研究以及生化史研究起到补充作用。
-
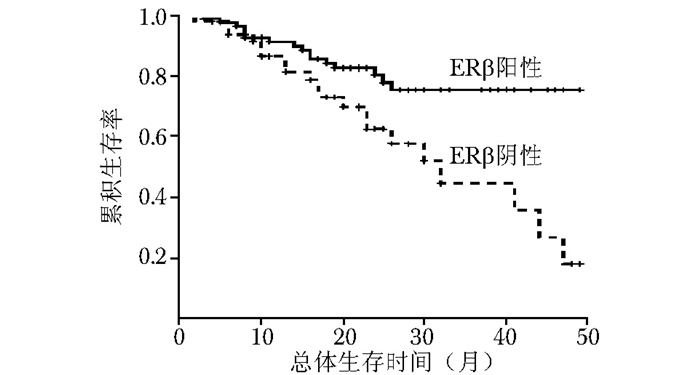
图 5 三阴乳腺癌中ERβ阳性与ERβ阴性患者的总体生存率比较
ERβ:同表 2
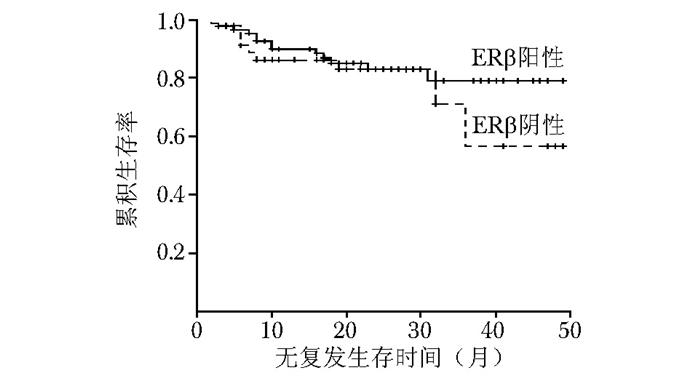
图 6 三阴乳腺癌中ERβ阳性与ERβ阴性患者的无复发生存率比较
ERβ:同表 2
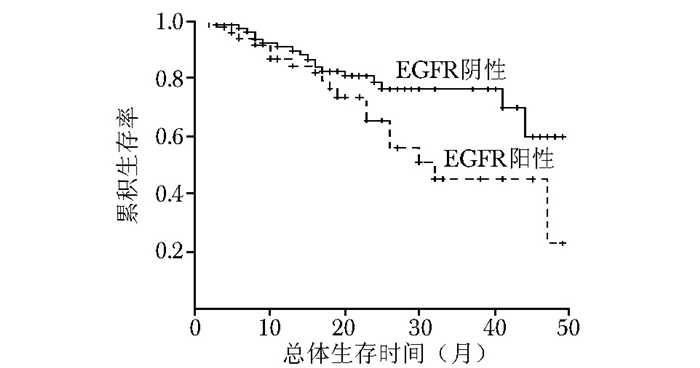
图 7 三阴乳腺癌中EGFR阳性与EGFR阴性患者的总体生存率比较
ERβ:同表 2
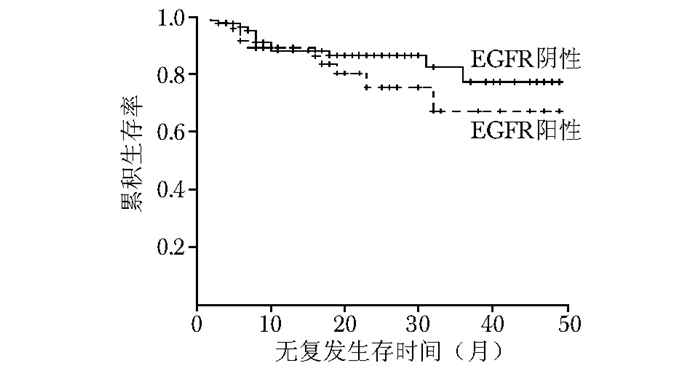
图 8 三阴乳腺癌中EGFR阳性与EGFR阴性患者无复发生存率比较
ERβ:同表 2
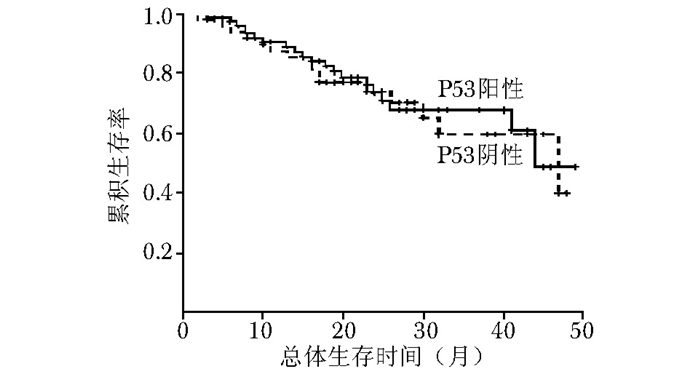
图 9 三阴乳腺癌中P53阳性与P53阴性患者的总体生存率比较
ERβ:同表 2
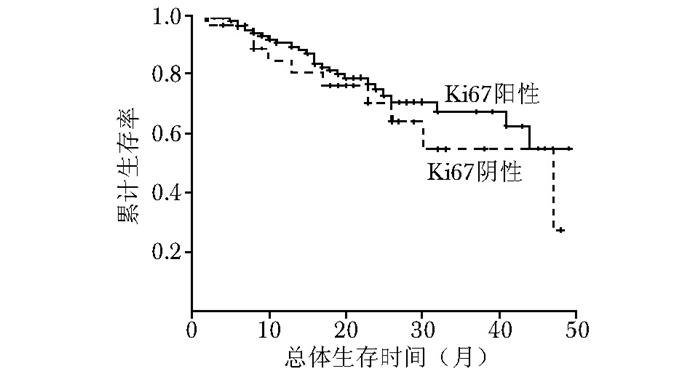
图 10 三阴乳腺癌中Ki67阳性与Ki67阴性患者的总体生存率比较
ERβ:同表 2
表 1 三阴乳腺癌与非三阴乳腺癌患者的临床病理特征比较[例(%)]
病理分型 发病年龄(岁) 家族史 病理类型 淋巴结状态 是否累及乳头 临床分期 肿瘤最大直径(cm) 分化程度 手术方式 ≤35 >35 有 无 浸润性导管癌 其他 阳性 阴性 是 否 Ⅰ期 Ⅱ期 Ⅲ期 ≤2 2~5 ≥5 高分化 中分化 低分化 改良根治术 其他 三阴乳腺癌
(n=135)18(13.3) 117(86.7) 10(7.4) 125(92.6) 117(86.7) 18(13.3) 76(56.3) 59(43.7) 4(3.0) 131(97.0) 35(25.9) 95(70.4) 5(3.7) 35(25.9) 95(70.4) 5(3.7) 21(15.5) 58(43.0) 56(41.5) 86(63.7) 49(36.3) 非三阴乳腺癌
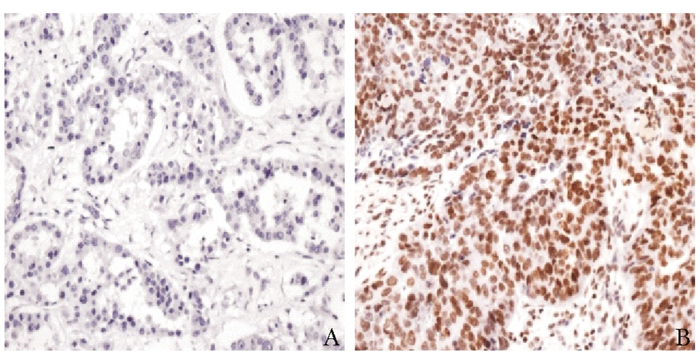
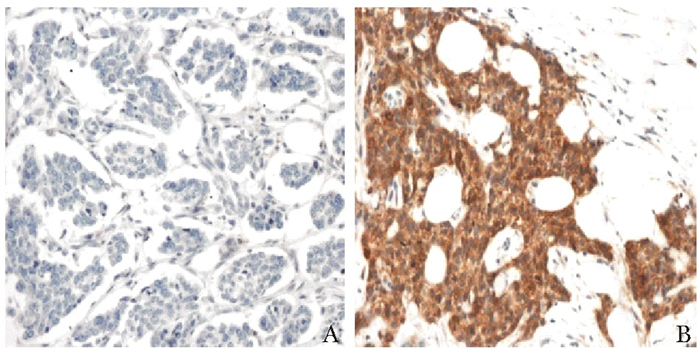
(n=728)52(7.1) 676(92.9) 18(2.5) 710(97.5) 475(65.2) 253(34.8) 218(29.9) 510(70.1) 15(2.1) 713(97.9) 260(35.7) 418(57.4) 50(6.9) 260(35.7) 418(57.4) 50(6.9) 116(15.9) 424(58.2) 188(25.8) 587(80.6) 141(19.4) χ2值 5.855 8.835 24.255 35.206 0.431 8.196 8.196 14.645 19.008 P值 0.016 0.003 < 0.001 < 0.001 0.512 0.017 0.017 0.001 < 0.001 表 2 三阴乳腺癌与非三阴乳腺癌患者的免疫组织化学指标表达差异[例(%)]
病理分型 ERβ EGFR 病理类型 P53 Ki67 (-) (+) (++) (+++) (-) (+) (++) (+++) (-) (+) (-) (+) (++) (+++) 三阴乳腺癌(n=135) 49(36.3) 64(47.4) 20(14.8) 2(1.5) 51(37.8) 30(22.2) 37(27.4) 17(12.6) 三阴乳腺癌(n=135) 51(37.8) 84(62.2) 29(21.5) 26(19.3) 30(22.2) 50(37.0) 非三阴乳腺癌(n=135) 33(24.4) 59(43.7) 27(20.0) 16(11.9) 90(66.7) 12(8.9) 7(5.2) 26(19.3) 非三阴乳腺癌(n=135) 62(45.9) 73(54.1) 26(19.3) 76(56.3) 16(11.9) 17(12.6) χ2值 4.484 22.578 χ2值 1.841 0.205 P值 0.034 < 0.001 P值 0.175 0.650 ERβ:雌激素受体β;EGFR:表皮生长因子受体 表 3 三阴乳腺癌患者ERβ表达与临床病理特征的关系[例(%)]
ERβ表达 发病年龄(岁) 家族史 淋巴结状态 是否累及乳头 临床分期 肿瘤最大直径(cm) 分化程度 P53 Ki67 EGFR ≤35 >35 有 无 阳性 阴性 是 否 Ⅰ期 Ⅱ期 Ⅲ期 ≤2 2~5 ≥5 高分化 中分化 低分化 (-) (+) (-) (+) (-) (+) 阴性(n=49) 11(22.4) 38(77.6) 4(8.2) 45(91.8) 41(83.7) 8(16.3) 2(4.1) 47(95.9) 3(6.1) 43(87.8) 3(6.1) 3(6.1) 43(87.8) 3(6.1) 3(6.1) 15(30.6) 31(63.3) 21(42.9) 28(57.1) 15(30.6) 34(69.4) 31(63.3) 18(36.7) 阳性(n=86) 7(8.1) 79(91.9) 2(2.3) 84(97.7) 35(40.7) 51(59.3) 2(2.3) 84(97.7) 32(37.2) 52(60.5) 2(2.3) 32(37.2) 52(60.5) 2(2.3) 18(20.9) 43(50.0) 25(29.1) 30(34.9) 56(65.1) 14(16.3) 72(83.7) 20(23.3) 66(76.7) χ2值 5.531 8.920 23.432 0.335 16.154 16.154 15.930 0.844 3.802 0.844 P值 0.019 0.003 < 0.001 0.563 < 0.001 < 0.001 < 0.001 0.358 0.051 < 0.001 ERβ、EGFR:同表 2 -
[1] Zheng G, Peng F, Ding R, et al. Identification of proteins responsible for the multiple drug resistance in 5-fluorouracil-induced breast cancer cell using proteomics analysis[J]. Cancer Res Clin Oncol, 2010, 136:1477-1488. DOI: 10.1007/s00432-010-0805-z
[2] Perou CM, Softie T, Eisen MB, et al. Molecular portraits of human breast turnouts[J].Nature, 2000, 406:747-752. DOI: 10.1038/35021093
[3] Strehl JD, Wachter DL, Fasching PA, et al. Invasive breast cancer:recognition of molecular subtypes[J]. Breast Care(Basel), 2011, 6:258-264. http://europepmc.org/articles/PMC3225209/
[4] Dent R, Trudeau M, Pritchard KJ, et al. Triple negative breast cancer:features and patterns of recurrence[J]. Clin Cancer Res, 2007, 13:4429-4434. DOI: 10.1158/1078-0432.CCR-06-3045
[5] Abkevich V, Timms K, Hennessy B, et al. Patterns of genomic loss of heterozygosity predict homologous recombination repair defects in epithelial ovarian cancer[J]. Br J Cancer, 2012, 107:1776-1782. DOI: 10.1038/bjc.2012.451
[6] Van den Akker EB, Verbruggen B, Heijmans BT, et al.Integrating protein-protein interaction networks with gene-gene co-expression networks improves gene signatures for classifying breast cancer metastasis[J]. Integr Bioinform, 2011, 8:188. http://europepmc.org/abstract/MED/22180387
[7] Carey LA, Dees EC, Sawyer L, et al.The triple negative paradox:primary tumor chemosensitivity of breast cancer subtypes[J].Clin Cancer Res, 2007, 13:2329-2334. DOI: 10.1158/1078-0432.CCR-06-1109
[8] Bauer KR, Brown M, Cress RD, et al.Descriptive analysis of estrogen receptor(ER)-negative, progesterone receptor(PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype:a population-based study from the California cancer Registry[J].Cancer, 2007, 109:1721-1728. DOI: 10.1002/cncr.22618
[9] Wirapati P, Sotirlou C, Kunkel S, et al.Meta-analysis of gene expression profiles in breast cancer:toward a unified understanding of breast cancer subtyping and prognosis signatures[J]. Breast Cancer Res, 2008, 10:R65. DOI: 10.1186/bcr2124
[10] Kuiper GG, Enmark E, Pelto-Huikko M, et al. Cloning of a novel receptor expressed in rat prostate and ovary[J]. Proc Natl Acad Sci USA, 1996, 93:5925. DOI: 10.1073/pnas.93.12.5925
[11] Cuzick J, Dowsett M, Pineda S, et al. Prognostic value of a combined estrogen receptor, progesterone receptor, Ki-67, and human epidermal growth factor receptor 2 immunohistochemical score and comparison with the Genomic Health recurrence score in early breast cancer[J]. J Clin Oncol, 2011, 29:4273-4278. DOI: 10.1200/JCO.2010.31.2835
[12] Murphy LC, Leygue E. The role of estrogen receptor-β in breast cancer[J]. Semin Reprod Med, 2012, 30:5-13. DOI: 10.1055/s-0031-1299592
[13] Murphy LC, Leygue E. A bi-faceted role of estrogen receptor β in breast cancer[J]. Endocri Relat Cancer, 2013, 20:R127-R139. DOI: 10.1530/ERC-12-0389
[14] Speirs V, Malone C, Walton DS, et al. Increased expression of estrogen receptor beta mRNA in tamoxifen-resistant breast cancer patients[J]. Cancer Res, 1999, 59:5421-5424. http://europepmc.org/abstract/med/10554009
[15] Sugiura H, Toyama T, Hara Y, et al. Expression of estrogen receptor β wild-type and its variant ER-βcx/β2 is correlated with better prognosis in breast cancer[J]. Jpn J Clin Oncol, 2007, 37:820-828. DOI: 10.1093/jjco/hym114
[16] Corkery B, Crown J, Clynes M, et al. Epidermal growth factor receptor as a potential therapeutic target in triple negative breast cancer[J].Ann Oncol, 2009, 20:862-867. DOI: 10.1093/annonc/mdn710
[17] Ulivi P, Zoli W, Capelli L, et al. Target therapy in NSCLC patients:relevant clinical agents and tumor molecular characterization[J]. Mol Clin Oncol, 2013, 7:575-581. http://www.onacademic.com/detail/journal_1000038007664910_bf8d.html
[18] Nielsen TO, Hsu FD, Jensen K, et al.Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma[J].Clin Cancer Res, 2004, 10:5367-5374. DOI: 10.1158/1078-0432.CCR-04-0220
[19] Davidoff AM, Herndon JE, Glover NS, et al.Relation between p53 over expression and established prognostic factors in breast cancer[J].Surgery, 1991, 110:259-264. http://www.ncbi.nlm.nih.gov/pubmed/1858036
[20] Bhatavdekar JM, Patel DD, Shah NG, et al.Prognostic significance of immunohistochemically localized biomarkers in stageⅡ and stage Ⅲ breast cancer:a multivariate analysis[J]. Ann Surg Oncol, 2000, 7:305-311. DOI: 10.1007/s10434-000-0305-5

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS


 下载:
下载: