Effect of RNA Interference Plasmid on the Expression of Oncogene AKT2 in Pancreatic Cancer Cell Line Panc-1
-
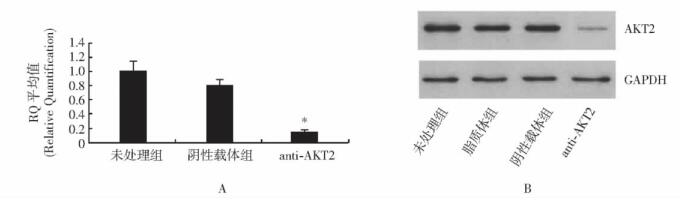
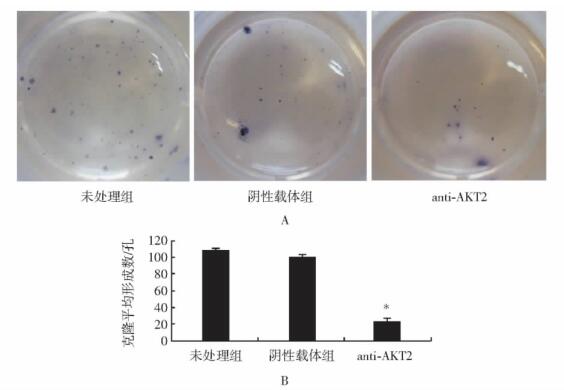
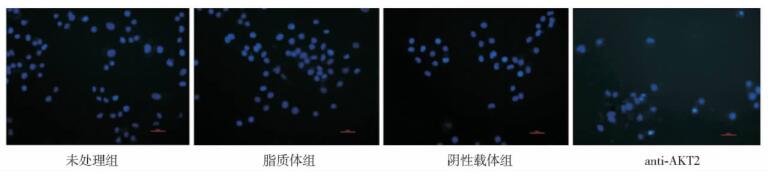
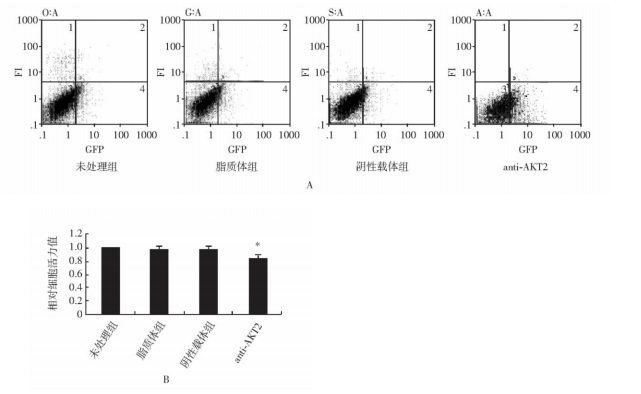
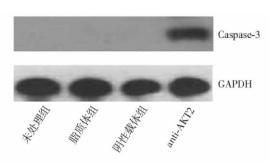
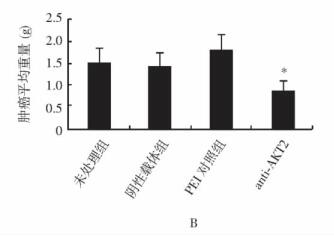
摘要:目的 探讨RNA干扰质粒抑制胰腺癌细胞系Panc-1原癌基因AKT2的表达对胰腺癌细胞生长和凋亡的影响, 并初步探讨其作用机制。方法 选择胰腺癌细胞系Panc-1, 构建特异性抑制AKT2表达的RNA干扰质粒, 瞬时和稳定转染胰腺癌细胞, 采用MTT法及软琼脂克隆形成实验检测胰腺癌细胞生长能力, Heochst染色及Annexin V-FITC/PI染色法检测细胞凋亡情况, 通过Western blot方法检测凋亡蛋白caspase-3表达; 并进行裸鼠移植瘤体内转染实验。结果 采用RNA干扰质粒沉默胰腺癌细胞系Panc-1原癌基因AKT2, 能够有效抑制胰腺癌细胞Panc-1体外生长能力、促进细胞凋亡, 诱导凋亡激酶caspase-3的表达; 动物体内实验结果显示, 干扰质粒能够有效抑制胰腺癌细胞系Panc-1在动物体内的成瘤能力。结论 RNA干扰质粒抑制原癌基因AKT2表达, 可有效抑制胰腺癌细胞生长, 促进凋亡, 针对原癌基因AKT2的基因治疗对胰腺癌具有重要的潜在应用价值。Abstract:Objective To explore the effect of RNA interference (RNAi) plasmid on proliferation, apoptosis of status of Panc-1 cells by silencing oncogene AKT2, and investigate its possible mechanism.Methods Pancreatic cancer cell line Panc-1 was applied to constructe the RNAi plasmid-targeting oncogene AKT2 and to transfect cells transiently and stably. The proliferation status was determined using CCK-8 method and soft agar colone formation test. The apotosis status of the cancer cells in vitro was determined using Heochst and Annexin V-FITC/PI methods. The protein level of AKT2 and caspase-3 kinase were detected using Western blotting. Finally, we evaluate the in vivo effect of the recombinant plamids on Panc-1 cells.Results By silencing the oncogenes AKT2, RNAi plasmid effectively down-regulate the mRNA and protein levels of of AKT2 in Panc-1 cells reduced cell proliferation and colony formation of Panc-1 cells, induced apoptosis in Panc-1 cells, increased the protein level of caspase-3 protein, and inhibited tumor growth in vivo.Conclusions RNAi can inhibit the expression of oncogene AKT2 and therefore effectively inhibit the growth of pancreatic cancer cells and promote their apoptosis. Gene therapy targeting AKT2 may be a promising target for pancreatic cancer.
-
Keywords:
- RNA interference /
- pancreatic cancer /
- Panc-1 cell line /
- gene therapy /
- protein kinase B
-
孕妇健康作为公共卫生内容之一,日益受到各级政府的重视。近年来,中国随着生育政策放开、人口老龄化、慢性疾病增加和社会经济发展,产科的服务能力凸显不足,医护人员工作压力加大。国家卫生计生委指出了在“互联网+”时代移动医疗的发展方向。随着信息化、数字化、移动互联网、物联网、大数据、云计算、人工智能等技术与便携式、可穿戴式设备的综合应用,移动医疗正逐步走向医院和家庭。这为解决健康重大公共卫生问题提供了新的手段。
可穿戴移动医疗设备在临床上早已广泛使用,比如常见的心电图仪、血压计、血氧仪等均可携带,检测后使用计算机读取数据并进行分析。此类设备可称为信息化和数字化时代的第一代可穿戴医疗设备,其专业性毋容置疑,在临床发挥着巨大的医用价值,但其舒适性和易用性较差。从医学角度看,可穿戴医疗设备的优点具体主要表现在两个方面:(1)某些特定专业设备的智能化、可穿戴化及便携化,可低成本监测脆弱人群(如孕妇或老人)自身健康与疾病状态,从而减少经济及时间成本。如可穿戴医疗设备不仅为具有心脏病史或妊娠合并心脏病的孕妇节省了检查费用,同时减少孕妇路程往返风险,从而提高监护质量,改善就医体验;(2)慢性疾病患者通过可穿戴设备可累积长期健康数据,避免传统疾病日记的不良依从性[1]。
随着智能移动终端设备的普及和互联网、物联网技术的迅速发展,可穿戴移动医疗设备在妇幼健康领域应用也越来越广,同时加速了智慧妇幼时代的到来[2]。对比传统孕妇监测设备,可穿戴设备突破了传统生理参数采集与医疗监护模式,可对孕妇的生命体征数据进行实时动态管理。孕妇通过可穿戴移动医疗设备,可自主监测胎心、血糖、血压、体重、脉搏、血氧、血脂、心电、尿液等项目。
孕妇可穿戴医疗设备是为孕妇设计的具有临床健康监护用途的随身配件。这种以配件为存在形式的新型医疗设备,融合了先进材料、传感、电路设计、信息传输和处理等前沿技术,在实现监护功能的同时给孕妇提供舒适便捷的使用体验。孕妇可穿戴技术的出现以及在医院中的应用与管理,不仅弥补了传统孕妇监护设备无法长时间、连续、动态监测的弊端,而且颠覆了传统孕妇健康监护管理模式。
1. 孕妇可穿戴设备及关键技术
1.1 孕妇可穿戴设备
目前,国内外各种孕妇可穿戴设备种类繁多,可对孕妇体重、血压、血糖、血氧、体温、胎心等生理参数进行随时随地监测与管理,解决了孕妇监护不便的问题[3]。李天魁等[4]研究了集成远程胎儿监护功能托腹带,结合手机软件实时显示,解决了围产期孕妇腰椎过度前凸导致的腰背疼痛、肌肉疲劳等健康问题。为了满足长期连续胎儿监控要求,李思君等[5]实现了基于微处理器的低功耗可穿戴式胎心音测量设备,较目前常用的单通道多普勒超声胎儿心动测量技术,可获得更加全面的监测数据。Fanelli等[6-7]通过可穿戴的硬件设备采集提取胎心率数据并传输至医院设备,医生分析结果后给出反馈,实现了家用胎心率的远程监控,使胎儿监护更加便捷和廉价。Hiyama等[8]研究了一种基于密集人群场景的可穿戴式胎儿保险杠,通过测量外界对孕妇腹部的推力来预测胎儿可能受到的危险。一种新型的正力测量传感器架构有效改善了测量精度和防止抖动干扰,实现了可穿戴式的宫缩检测[9]。美国Bloomlife公司研发了一款妊娠晚期可穿戴设备Belli,能够监测跟踪孕妇胎动等统计数据并即时发送到智能手机APP上[10]。
1.2 孕妇可穿戴设备的关键技术
新型材料、高性能传感器、低功耗电池以及安全有效的无线传输技术是孕妇可穿戴设备的关键技术,推动着孕妇可穿戴设备不断更新发展。
1.2.1 可穿戴材料
可穿戴设备需直接佩戴在孕妇身上,并覆盖在高度柔展的皮肤表面。对孕妇来说,可穿戴设备的舒适性、轻便性、耐用性和灵活性非常重要。基于纤维结构的材料非常理想,同时,新型导体和半导体材料的发展为孕妇可穿戴设备的设计提供了新的动力,例如导电高分子聚合物、金属和金属氧化物的纳米粒子、碳基纳米材料等[11-12],在具有良好导电性的同时,又具有很好的机械特性。导电织物具有柔软、轻薄、易拉伸变形的特点[13],非常适合于孕妇穿戴。
1.2.2 传感器
穿戴式设备监测孕妇获得的各种生理参数和体征信号均需依靠强大的生物传感技术[14]。因此,高灵敏抗噪的柔性传感器设计是孕妇可穿戴设备的核心之一。随着材料和电子技术的进步,可穿戴生物传感器性能逐渐升级。较为常见的传感器包括监测心电的导电织物、监测脉搏和血氧的光电传感指环、监测呼吸的压电腰带和胸带、监测体温的红外线耳环等[15]。可穿戴传感器向着功能更多、信号更稳定和功耗更低方向不断发展。
1.2.3 电池
任何可穿戴设备均离不开电池,相比快速创新的孕妇可穿戴设备,可穿戴电池的发展速度则比较缓慢。尽管绝大多数可穿戴设备使用了蓝牙低能耗技术,但孕妇依然需频繁充电来确保设备电量充足。根据目前市场上各种可穿戴设备的使用情况,主要有以下几种电池技术:能量收集、锂离子电池、薄膜电池、石墨烯电池。各种电池技术均有不同优点和缺点[16]。超低功耗、高密度聚合物电池的使用,能够保证设备最大续航时间和最小体积及重量。而为了满足孕妇对舒适性的要求,柔性电池是当前研究的重点[12],以满足便携式和可穿戴的需求。
1.2.4 无线数据传输
可穿戴设备可采集到海量孕妇生理数据[14],同时,孕妇对舒适性与便携性的需求使其体积趋于小型化。因此,需将可穿戴终端采集的数据上传至智能手机或计算机等处理器或移动互联网云平台进行计算,计算结果再传至可穿戴终端反馈给孕妇,而高效安全的无线传输技术则是这种应用模式的保证[17]。目前使用较广泛的无线通信技术主要包括Wi-Fi、蓝牙、ZigBee、红外线等,其中,蓝牙和ZigBee常被用作孕妇可穿戴设备的数据传输方式,其优点是低功耗、低成本。
2. 孕妇可穿戴设备的应用
20世纪90年代孕妇可穿戴设备已在欧美各大医院得到普及,到2010年后逐步呈现走出医院、走向家庭,更多面向个人提供定向、个性服务发展的特点,并与智能移动终端和物联网技术发展紧密同步,同时与大数据和云计算结合起来,使妇幼保健从救治发展到预防阶段。例如,英国牛津大学采用移动胎儿监护仪可提高围产期保健质量,其能同时远程监护多名孕妇[18];美国Mercy医疗中心孕产妇和胎儿健康中心采用远程胎儿监护系统进行医生远程会诊、医患远程咨询[19];希腊约阿尼纳大学开发母胎健康多参数远程监护仪,可监护孕妇和胎儿的心电、血压、温度等数据[20]。
我国人口数量大,医疗资源相对缺乏,医疗配置不够合理。此外,随着全面二孩政策的放开,高龄与高危孕妇健康问题也日益突出。因此,构建一种新型孕妇健康应用模式,让有限的妇产科医疗资源达到最优化配置,让尽可能多的孕妇享受专业医疗指导和服务,成为全社会的共同愿望。二孩政策放开以来,全国进入了生育高峰期,医院产科爆满,而因场地所限,医院能够容纳的产检孕妇数量有限。孕妇在医院排队进行常规产检,仅胎心监测一项就需要约50 min,而采用可穿戴式胎儿心电设备在家进行监护,不仅节省了时间,还能够随时进行监测,有效降低了不良妊娠结局的发生率[21-22]。
对于妊娠合并高危因素[23-24],如妊娠合并糖尿病、高龄产妇贫血、妊娠期高血压、前置胎盘、巨大胎儿、多胎妊娠等,妇产科医生可在妊娠28周后建议孕妇使用可穿戴式胎心仪,在家进行自我监护,从而进行密切的动态监测,然后上传胎心监护图[25]。如图 1所示,医生可随时在移动智能终端APP查看胎心监测数据,并进行判读和针对性指导。另外,对于那些进行过不孕症治疗采用人工辅助生殖技术受孕、高龄、较为焦虑的孕妇,也可使用可穿戴式远程胎心仪在家监护并上传胎心图,让医护人员及时了解胎儿的当前情况。
通过可穿戴智能设备,医生可持续跟踪孕妇围产期健康情况和产后康复进展情况,及时发现潜在的风险因素。可穿戴智能设备还可动态评价药物疗效,例如可穿戴式母胎心电设备能够评估孕妇心律失常药物的疗效;针对妊娠期糖尿病,采用可穿戴无创血糖仪进行血糖监控;有些疾病加重概率高,如妊娠合并心脏病,所以孕妇需要实时监护心力衰竭以避免病情突变。
3. 我国孕妇可穿戴设备的管理
合理的孕妇可穿戴设备的管理,能够避免孕妇就医和住院治疗的次数,大大节约费用和人力成本。孕妇可穿戴设备的管理不仅依赖软硬件技术,更需要移动医疗和远程监护以及合理医疗管理模式的支撑。我国妇幼领域的医疗模式与国外不同,主要有两种管理模式:(1)设备制造及运营企业与医院直接合作;(2)企业建设自己的远程医疗中心。孕妇可穿戴设备的出现正在慢慢带动妇幼医疗健康行业的转型,同时也对现有的医疗模式提出了新的挑战。虽然孕妇可随时随地采集自身数据,但与院内监测的数据在精度上有很大不同。此外,由于其行业内部标准滞后于技术发展,相应法律、法规的建立也比较滞后。
基于孕妇可穿戴设备的远程监护管理流程如图 2所示。通过网络信息技术将胎心、血氧、血糖、血压等重要指标数据进行收集并传递到监护中心进行分析,帮助医院进行宫内胎儿生存状况综合判断。这样,医生可及时了解胎儿在整个妊娠期的生长发育情况,并给予孕妇相应的健康建议,及时预测、预防并处理影响胎儿的各种不良因素,如缺氧、宫内窘迫等。
胎心远程监护的典型应用与管理场景为通过连接可穿戴智能多普勒胎心仪,利用移动互联网,结合物联网技术,实现医院、医生和孕妇三大主体在数据基础上的实时无缝对接,可将医院胎心监测服务延伸至院外,显著提升医院的围产期健康管理水平,降低孕产妇死亡率。通过智能手机移动APP应用和信息管理平台实现孕妇与医生的互动交流。通过数据挖掘与分析及专业医生的判读与指导,实现自我健康管理。更重要的是,孕妇可穿戴设备的应用可及时发现孕妇健康隐患和高危因素,利于医院及早进行干预。
医院妇产科引入基于可穿戴设备的健康监护管理模式可实现对孕妇生命体征数据的动态实时管理,加强围产期监测,优化孕期质量,降低医院门诊产检压力,缓解产科医生工作强度[26-27]。通过“可穿戴设备物联网化+医院信息系统+互联网”打造全新的智慧妇幼管理模式,为医院与医院、医生与医生、医生与孕妇、医生与智能医疗器械、孕妇与智能医疗器械之间建立沟通桥梁,打通信息孤岛,优化就医流程,改善就医环境,提升医患满意度,为医护人员、医院管理者、卫生主管机构人员提供专业、高效的管理工具。
4. 存在问题
在孕妇可穿戴设备领域,通常认为设备监测的孕妇生理参数数据准确性是最大的问题,但设备管理方面的其他问题同样不容忽视。
4.1 设备管理尚未与现有医疗模式结合
目前管理的主要问题是无法通过电子医疗档案结合孕妇可穿戴设备建立并扩展新的管理模式。从医院角度,希望可查询、调用以不同组织方式呈现的记录;从妇幼保健管理角度,希望可建立不同孕妇健康管理平台的子系统。另外,孕妇可穿戴设备必须与现有医疗模式有机结合,仅提供单纯的数据采集功能很难激励孕妇和医生持续参与。只有应用于主流临床流程,使之成为能有效提供医疗服务模式的有机组成部分,通过人工智能算法的处理分析或由产科医疗人员进一步提供深入解读,为孕妇反馈有临床意义的信息并提供相应的解决方案,才是可穿戴设备实践应用能获得持续发展和广泛接受的关键。
4.2 体积大且配置与操作复杂
目前的可穿戴设备对于孕妇来说,远远不够小巧、轻便、美观、精致。无论是Monica母胎心率记录仪,还是三瑞SRF系列多普勒胎心仪,易穿戴性与易携带性均有待提高,且这些设备需由妇产科专家或医护人员指导或帮助进行佩戴;而轻便、安装与配置简便、佩戴舒适才是孕妇群体真正需求的。
4.3 电池续航时间短
电池续航问题对于孕妇可穿戴设备而言始终是痛点,由于长时间连续生物信息采集与监测功耗很大,电池容量有限,续航能力也较差, 影响了孕妇对可穿戴设备的使用。当前电池的密度无法通过其他技术手段改变,所以当前主要的解决方法是通过电源管理等技术来节省传感器和处理器的耗电量。同时,一些新电池技术的创新,比如无线充电和快速充电技术也逐渐被应用于可穿戴设备。
4.4 数据采集准确性差
在可穿戴设备使用较多的健康医疗领域,孕妇自行检测的最大问题是无法排斥意外因素带来的数据干扰,比如运动、情绪、服药、睡眠状况甚至天气异常变化带来的影响。此外,目前还缺乏专业的病理分析。可穿戴设备实现数据采集只是健康状况判断的第一步,由于缺乏云端专业的病理诊断和个性化处置方案,因此无法督促孕妇重视数据,改变自己的生活习惯和规律。对于可穿戴设备用于医疗监控,国家相关机构尚未给予明确规范与监管,导致可穿戴设备监测的数据缺乏标准化。因缺乏相应的规范制约,医院对这些数据并不完全认同,导致数据毫无使用价值。
4.5 指标单一
当前市场上,大部分孕妇可穿戴设备只能监测单一的生理数据,无法体现孕妇身体的其他健康指标,因此医生无法对孕妇身体状况作出准确判断。通过围产期多指标孕妇远程监测设备对孕妇的生理信号进行采集,包括胎心、胎动、宫缩、血糖、血压、血氧等指标,可以克服指标单一的问题,从而实现对孕妇进行全围产周期的实时管理。
4.6 个人隐私问题
可穿戴设备可记录的数据量越大、可获得的个人隐私越多,信息安全隐患就越大[28-29]。换句话说,如果孕妇使用这种可穿戴设备时间越久,关于孕妇个人一切信息将无处遁形,包括健康情况和生活偏好等,随时都可能被泄漏。
5. 展望
孕妇可穿戴设备及随之兴起的移动医疗模式可能为未来医疗模式带来巨大变革。各种可穿戴设备结合相应的健康管理系统,可自然、方便、实时记录孕妇自身各项生理参数,为孕妇健康管理和医学研究提供了更广阔的空间。孕妇可穿戴设备的未来发展可概括为如下几个主要方向。
5.1 互联网+
目前的孕妇可穿戴设备是移动互联网下的一个健康管理入口,并搭建基于可穿戴设备的孕妇垂直应用平台。通过接入互联网的可穿戴设备,孕妇可随时随地监测生理数据,并远程上传至医生端,这将彻底改变孕妇的生活方式和医院对孕妇的监护模式。
5.2 提供实时自动辅助诊断
目前,各种孕妇可穿戴健康监测设备的主要功能集中于实现孕妇生理健康指标变化的实时监测,实际上多数都是在扮演浅层的健康管理功能,与真正意义上的诊断及医疗概念相距甚远。因此,有助评价诊断的孕妇可穿戴设备是未来发展的重点,目标是实现实时动态分析与数据可视化,从而减少再入院率。
5.3 大数据挖掘
数据融合、信息整合以及大数据挖掘几乎是孕妇可穿戴设备对孕妇生理参数数据采集和管理领域未被探索的方向。为了为孕妇远程监护提供更好的预测性能和更准确的决策支持,需将不同的监测方式和设备进行整合,并引入自动分析系统,从而提高母儿监护的可靠性和准确性。
5.4 整合与细分趋势并存
随着针对孕妇可穿戴设备市场的蓬勃发展,产品类型将呈现整合与细分并行的发展趋势。随着技术的快速发展,可穿戴设备的局限性将会得到进一部解决。设备的功能将越来越完善,专属应用会越来越丰富,价格将变得越来越低廉。
总之,在妇幼保健领域,孕妇可穿戴设备已逐渐从基础研究走向实际应用。基于孕妇可穿戴设备的新型医疗监护模式能实现对生命体征数据的动态实时管理,提高产科医护人员的工作效率和服务质量,从而提升医院的医疗质量管理水平。
-
-
[1] Davidson BL, McCray PB Jr. Current prospects for RNA in-terference-based therapies[J]. Nat Rev Genet, 2011, 12:329-340. DOI: 10.1038/nrg2968
[2] Murthy SS, Tosolini A, Taguchi T, et al. Mapping of AKT3, encoding a member of the Akt/protein kinase B family, to human and rodent chromosomes by fluorescence in situ hybridization[J]. Cytogenet Cell Genet, 2000, 88:38-40. DOI: 10.1159/000015481
[3] Testa JR, Bellacosa A. AKT plays a central role in tumorigenesis[J]. Proc Natl Acad Sci USA, 2001, 98:10983-10985. DOI: 10.1073/pnas.211430998
[4] Ruggeri BA, Huang L, Wood M, et al. Amplification and overexpression of the AKT2 oncogene in a subset of human pancreatic ductal adenocarcinomas[J]. Mol Carcinog, 1998, 21:81-86. DOI: 10.1002/(SICI)1098-2744(199802)21:2<81::AID-MC1>3.0.CO;2-R
[5] Altomare DA, Tanno S, De Rienzo A, et al. Frequent activation of AKT2 kinase in human pancreatic carcinomas[J]. J Cell Biochem, 2002, 87:470-476. DOI: 10.1002/jcb.10287
[6] Haller DG. New perspectives in the management of pancreas cancer[J]. Semin Oncol, 2003, 30:3-10. DOI: 10.1016/S0093-7754(03)00119-2
[7] Fire A, Xu S, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391:806-811. DOI: 10.1038/35888
[8] Hannon GJ, Rossi JJ. Unlocking the potential of the human genome with RNA interference[J]. Nature, 2004, 431:371-378. DOI: 10.1038/nature02870
[9] Scherr M, Battmer K, Winkler T, et al. Specific inhibition of bcr-abl gene expression by small interfering RNA[J]. Blood, 2003, 101:1566-1569. DOI: 10.1182/blood-2002-06-1685
[10] Michael MZ, O'Connor SM, van Holst Pellekaan NG, et al. Reduced accumulation of specific microRNAs in colorectal neoplasia[J]. Mol Cancer Res, 2003, 1:882-891. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=8333ff0709bc69cc65a1352ce570517f
[11] Brummelkamp TR, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference[J]. Cancer Cell, 2002, 2:243-247. DOI: 10.1016/S1535-6108(02)00122-8
[12] Yamamoto S, Tomita Y, Hoshida Y, et al. Prognostic significance of activated Akt expression in pancreatic ductal adenocarcinoma[J]. Clin Cancer Res, 2004, 10:2846-2850. DOI: 10.1158/1078-0432.CCR-02-1441
[13] Liu X, Shi Y, Giranda VL, et al. Inhibition of the phosphatidylinositol 3-kinase/Akt pathway sensitizes MDAMB468 human breast cancer cells to cerulenin-induced apoptosis[J]. Mol Cancer Ther, 2006, 5:494-501. DOI: 10.1158/1535-7163.MCT-05-0049
[14] Shimamura H, Terada Y, Okado T, et al. The PI3-kinaseAkt pathway promotes masangial cell survival and inhibits apoptosis in vitro via NF-kappa B and Bad[J]. J Am Soc Nephrol, 2003, 14:1427-1434. DOI: 10.1097/01.ASN.0000066140.99610.32
[15] Guo S, Sonenshein GE. Forkhead box transcription factor FOXO3a regulates estrogen receptor alpha expression and is repressed by the Her-2/neu/phosphatidylinositol 3-kinase/Akt signaling pathway[J]. Mol Cell Biol, 2004, 24:8681-8690. DOI: 10.1128/MCB.24.19.8681-8690.2004
[16] Terraqni J, Graham JR, Adams KW, et al. Phosphatidylinositol 3-kinase signaling in proliferating cells maintains an anti-apoptotic transcriptional program mediated by inhibition of FOXO and non-canonical activation of NFkappaB transcription factors[J]. BMC Cell Biol, 2008, 9:6. DOI: 10.1186/1471-2121-9-6
[17] Zhang X, Jin B, Huang C. The PI3K/Akt pathway and its downstream transcriptional factors as targets for chemoprevention[J]. Curr Cancer Drug Targets, 2007, 7:305-316. DOI: 10.2174/156800907780809741
[18] Kang YC, Kim KM, Lee KS, et al. Serum bioactive lysophospholipids prevent TRAIL-induced apoptosis via PI3K/Akt-dependent cFLIP expression and Bad phosphorylation[J]. Cell Death Differ, 2004, 11:1287-1298. DOI: 10.1038/sj.cdd.4401489
[19] Panka DJ, Mano T, Suhara T, et al. Phosphatidylinositol 3-kinase/Akt activity regulates c-FLIP expression in tumor cells[J]. J Biol Chem, 2001, 276:6893-6896. DOI: 10.1074/jbc.C000569200
-
期刊类型引用(0)
其他类型引用(2)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS


 下载:
下载: