Application of Different Perioperative Anesthesia Plans and Multimodal Analgesia in Enhanced Recovery after Surgery for Open Pancreaticoduodenectomy
-
摘要:目的 评估不同麻醉与多模式镇痛在开腹胰十二指肠切除术加速康复外科(enhanced recovery after surgery, ERAS)策略中的安全性与有效性。方法 采用回顾性队列研究, 收集2016年3月至2018年4月北京协和医院39例开腹胰十二指肠切除术患者的临床资料, 其中19例采用ERAS治疗方案(ERAS组), 20例采用常规治疗方案(对照组), 比较两组患者术中血流动力学相关指标、外周组织灌注情况及麻醉相关术后早期恢复指标、住院时间、ICU停留时间、住院费用的差异。结果 ERAS组患者术中阿片药用量、出室前血乳酸浓度显著低于对照组(P均 < 0.05), 术后第一天外周血白细胞数量及中性粒细胞数量、血糖、术后早期阿片药用量、疼痛及恶心评分、镇痛满意度、拔除导尿管和胃管时间、术后首次下床活动时间、首次排气时间、住院费用各项指标均显著优于对照组(P均 < 0.05);两组患者手术时间、术中血流动力学相关指标、出血量无显著差异(P均>0.05)。结论 应用不同ERAS麻醉与多模式镇痛策略可有效减轻开腹胰十二指肠切除术患者的手术应激、减少阿片药用量、促进术后早期恢复、缩短住院时间、降低住院费用。Abstract:Objective This study aimed to evaluate the safety and effectiveness of different anesthetic approaches and multimodal analgesia in enhanced recovery after surgery (ERAS) when applied to open pancreaticoduodenectomy patients.Methods In this retrospective cohort study, we consecutively collected clinical data from 39 patients undergoing open pancreaticoduodenectomy in Peking Union Medical College Hospital from March 2016 to April 2018, among which 19 patients received ERAS strategy (ERAS group) and 20 traditional strategy (control group), and compared the differences in intra-operative hemodynamic changes, post-operative rehabilitation, length of stay, and costs between the ERAS group and the control group.Results The intraoperative opioid consumption and postoperative lactic acid in the ERAS group were lower than those in the control group (both P < 0.05). White blood cell and neutrophil counts on the postoperative day 1, blood glucose, pain score, postoperative nausea and vomiting, postoperative analgesia satisfaction, time to remove the transurethral catheter and nasogastric tube, time to exhaust and ambulation, and medical costs were all improved compared to the control group (all P < 0.05). Whereas operating duration, intraoperative hemodynamic changes, and intraoperative bleeding were comparable between the two groups (all P>0.05).Conclusion Different perioperative anesthesia plans and multimodal analgesia in ERAS strategy are safe when applied to open pancreaticoduodenectomy patients. It could effectively mitigate operative stress, decrease opioid exposure, expedite postoperative rehabilitation, shorten the length of hospital stay, and decrease medical cost.
-
随着测序技术的发展与进步,肠道微生态与人类疾病之间的关系逐渐被发现,其在维持人体肠道上皮屏障和宿主免疫功能方面的重要作用备受关注。已有研究表明,肠道微生态与多种疾病的发病机制相关,如神经精神性疾病、自身免疫性疾病、癌症以及慢性代谢性疾病等[1-5]。近年来的研究发现,肠道微生态在血流动力学的调控中亦发挥着重要作用。本文通过回顾文献,梳理在人体生理以及重症状态下肠道微生态与血流动力学之间的关系,以期为进一步开展相关研究提供借鉴。
1. 肠道微生态构成及其生理作用
人体肠道微生态由原核微生物(如细菌)、真核微生物(如真菌和原生动物)以及病毒组成[6]。肠道微生物群主要存在于大肠中,约70%分布于结肠,胃、十二指肠、空肠中较少。健康成人肠道内有超过30万亿个微生物,约是人体细胞数量的10倍,重约1~1.5 kg,其中共生和机会性细菌超过2900种[7]。在健康肠道微生物菌群中,革兰氏阴性的拟杆菌门(主要为拟杆菌或普雷沃氏菌)和革兰氏阳性的厚壁菌门(主要为梭菌和乳杆菌)占90% 以上[8],其余还包括变形菌门、放线菌门、疣微菌门等,真菌占比不足1%。它们共同构成了一个强大的“器官”,影响机体的多数生理功能[9]。
一方面,肠道微生物可降解食物中难消化的多糖,并将其分解成各种代谢物,如短链脂肪酸(short chain fatty acids,SCFAs)。这些SCFAs不仅能在肠道中被吸收,为肠上皮细胞提供能量,维持肠上皮黏膜屏障完整,同时又是有效的抗炎化合物,可通过抑制核因子κB(nuclear factor-κB,NF-κB)减少细胞因子的产生[10-11]。此外,肠道微生物的代谢物可被结肠黏膜吸收,并可通过内分泌方式或胆汁酸的代谢过程发挥功能,影响机体生理过程[12]。另一方面,肠道微生物有助于合成人体维生素K、维生素B12、核黄素、硫胺素、叶酸和必需氨基酸,同时,肠道微生物菌群可通过共生菌和病原菌之间的竞争作用,在防御消化道感染以及建立局部免疫防御方面发挥作用[13]。
2. 生理状态下肠道菌群对血流动力学的调控作用
肠黏膜是外部环境和宿主内部环境之间的屏障,由肠上皮细胞紧密连接组成。生理状态下,肠上皮细胞通过Toll样受体系统参与识别肠道内微生物相关分子模式,释放细胞因子、分泌黏液、IgA、抗微生物肽以及SCFAs激活Treg细胞等,对肠道内的微生物群产生免疫耐受[14-16],维持肠道微生态与机体处于平衡状态。同时,微生物群可通过氧化三甲胺(trimethyla-mine oxide,TMAO)、SCFAs及其受体对血流动力学发挥调控作用。
2.1 TMAO
肠道微生物从肉类、鱼类和鸡蛋等食物的胆碱、卵磷脂和肉碱中,通过多种微生物酶复合体分解产生三甲胺并进入门脉循环,在门脉循环中,三甲胺被肝脏黄素单加氧酶氧化为TMAO[17]。TMAO大部分在肾脏中被清除,其余部分在肠道中被还原为三甲胺。TMAO可存在于心脏、肾脏或其他组织中并参与多种生化过程,如激活血小板聚集、促进泡沫细胞形成、诱导炎症反应等[18-20],参与机体血流动力学调控。首先,尿液和血浆中TMAO浓度升高是慢性肾功能衰竭的标志[21-22],血浆中TMAO水平升高可影响肾素-血管紧张素系统,并导致肾间质纤维化和功能障碍,促进钠和水潴留,引起血压升高[23]。其次,TMAO可激活和促进机体炎症反应,给予小鼠喂食TMAO可直接激活其炎症通路,如NF-κB信号通路,导致血管平滑肌细胞发生炎症反应,激活的炎症反应能够诱导NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)形成炎症小体,产生白细胞介素(interleukin,IL)-1β和IL-18[24],进一步促进内皮细胞炎症,引起线粒体活性氧、硫氧还原蛋白相互作用蛋白的产生和溶酶体失稳态,进而使内皮细胞的增殖和迁移受损,最终导致血管收缩,血压升高。此外,TMAO升高能够引起心力衰竭。一方面,TMAO可导致心肌肥厚和纤维化[25]; 另一方面,TMAO的增加可通过丙酮酸和脂肪酸氧化,影响心脏能量代谢和线粒体功能,最终导致心室重塑和心力衰竭的发生[26]。最后,TMAO可通过NF-κB、MAPK/NF-κB等途径,诱导单核细胞粘附内皮细胞,TNF-α、IL-6、C-反应蛋白表达增加,促进血管炎症,导致毛细血管渗漏,引起血压下降,导致血流动力学不稳定[27]。
2.2 SCFAs及其受体
肠道厌氧微生物群发酵食物中的膳食纤维可产生SCFAs等代谢物,这有助于维持肠黏膜屏障的完整性并促进宿主的免疫反应[28]。SCFAs是结肠上皮细胞的主要能量来源,有助于维持功能性细胞间连接。同时,SCFAs通过调控辅助性T细胞、调节性T细胞等细胞抗体和细胞因子的产生,在肠道免疫中发挥作用,这种作用主要为抗炎作用。SCFAs还可诱导上皮细胞中的细胞保护蛋白,在应激条件下维持细胞活力,同时,SCFAs能够通过抑制组蛋白去乙酰化酶活性,调节蛋白的乙酰化修饰,减少免疫细胞分泌促炎因子,维持肠道免疫稳态[29-30]。
SCFAs是肠道微生物代谢产物之一,主要为乙酸盐、丙酸盐和丁酸盐[31]。近年来发现多种SCFAs受体和血压调控机制有关,主要包括嗅觉受体78(Olfr78)、G蛋白偶联受体41(Gpr41)、G蛋白偶联受体43(Gpr43)。
Olfr78对乙酸盐和丙酸盐较为敏感[32]。其存在于多种已知对血压调节具有重要作用的阻力血管中,如肾入球小动脉。众所周知,血液通过入球小动脉进入肾小球进行过滤,该小动脉是肾素(肾素-血管紧张素-醛固酮系统中的初始调控因子)储存的位置。肾素-血管紧张素-醛固酮系统是调控血压的重要机制,入球小动脉通过储存和分泌肾素在血压控制中起着重要作用。Olfr78分布于阻力血管和入球小动脉,SCFAs可促使肾素分泌和血管收缩,从而在组织血流调节和液体调节中发挥重要作用[32]。
Gpr41和Gpr43对乙酸盐和丙酸盐亦较为敏感[33-35],可在多种组织中表达。例如,内皮细胞中的Gpr41和Gpr43,能够舒张血管内皮细胞,从而导致血压下降[36]。Gpr43可对肠道微生物群产生的SCFAs作出反应,参与多种病理生理过程,如炎症反应[33, 35]。研究发现,在血浆丙酸盐的基础水平(0.1~1.0 mmol/L),SCFAs主要通过Gpr41、Gpr43作用于内皮细胞,促进血管舒张,发挥降压作用,当丙酸盐浓度>1.0 mmol/L时,SCFAs主要通过Olfr78发挥升压作用[33-34, 37]。
3. 重症患者肠道微生态对血流动力学的影响
重症患者由于休克、炎症反应、免疫功能受损、饮食、药物改变、肠道活动能力下降、肠道灌注不足等原因导致肠道菌群失调[38],肠黏膜结构破坏以及菌群易位。肠道微生态紊乱可减少SCFAs的生成,同时使TMAO浓度增加,加重血管炎症反应,影响血流动力学稳定[39-40]。而肠道菌群易位不仅可引起机体炎症反应,造成血管通透性增加、液体渗漏以及血流动力学不稳定,还会直接影响心肌收缩功能。
首先,重症患者由于电解质波动、营养结构/方式的改变以及镇静剂的频繁使用,引起肠道运动能力下降、肠上皮完整性降低,导致“有益”厌氧菌科(如毛螺菌科和瘤胃球菌科)减少或缺失,进一步损害肠上皮屏障功能,引起机会致病菌过度生长和易位[41]。
其次,ICU常用的抗生素、非甾体抗炎药、β受体阻滞剂或质子泵抑制剂等药物可直接影响肠道微生物群的组成[42-44]。研究证实,重症患者共生肠道细菌(如厚壁菌或拟杆菌)减少以及潜在致病细菌(如变形杆菌、肠球菌属、艰难梭菌属、葡萄球菌属等)增加[28]。重症患者肠道菌群易位可导致SCFAs浓度降低,还可直接刺激机体免疫系统,激活内皮细胞、炎症细胞等效应细胞,进一步释放细胞因子、前列腺素I2、氧自由基、蛋白酶、血栓素A2等,引起炎症反应[45-46]。炎症因子升高初期,血管内皮细胞结构破坏,细胞功能出现障碍,外周血管阻力增加,血管平滑肌细胞大量增殖,诱发血管收缩,引起血压升高。随着炎症反应的增强,出现“瀑布”样炎症反应,诱发毛细血管渗漏综合征,患者出现血压下降甚至休克[47]。同时,机体炎症介质释放,损伤心肌细胞,血管加压素、血管紧张素等激素的缩血管作用降低,血管呈现麻痹状态,加剧血流动力学的紊乱[48]。
再次,肠道菌群紊乱引起血液中TMAO水平升高,TMAO水平升高后,可通过上述生理调控途径,导致血流动力学不稳定。同时,TMAO能够诱导组织因子的表达,促进血栓形成和血管炎症发生发展[49-50],进一步导致血流动力学不稳定。
此外,肠道菌群紊乱可影响心肌收缩力[51]。肠道菌群紊乱诱发的炎症反应会释放肿瘤坏死因子和IL-1β等炎症因子,这些炎症因子能够直接抑制心肌细胞。细胞因子还能够激活诱导型一氧化氮合酶,其过度表达可引起血管扩张,导致低血压[52]。强烈的炎症反应还会引起β-肾上腺素能受体在全身和心肌中下调,导致血管和心肌对儿茶酚胺的反应性均降低[53]。肠道菌群易位,内毒素释放入血还会引起线粒体DNA损伤,线粒体内钙离子水平升高和自由基增多,诱导线粒体通透性转换孔开放,导致膜电位下降,ATP合成障碍,钙离子超载,细胞器肿胀并最终破裂,引起心脏能量代谢障碍[54]。
4. 血流动力学改变对肠道微生态的影响
血流动力学不稳定在重症患者中较为常见,重症患者血流动力学改变,全身血流重新分配,肠道缺血再灌注损伤易造成肠上皮屏障破坏、肠道菌群紊乱及免疫功能失衡,最终导致肠源性菌群易位,引起全身炎症反应和感染发生。而休克患者由于机体的代偿机制,休克早期内脏血管选择性收缩以保证重要器官的灌注,此时可直接引起胃肠道黏膜缺血缺氧,导致肠上皮坏死、脱落,肠道黏膜屏障功能受损,通透性增高,肠道菌群失调和易位[55]。动物实验表明,大鼠发生肠道缺血或缺血再灌注损伤后,回肠菌群发生了明显改变,主要表现为有害菌如大肠埃希菌等明显增加,而益生菌如乳酸杆菌等明显减少,提示肠道缺血缺氧性损伤可引起肠道菌群改变[56]。目前已有临床研究表明,重症患者因心力衰竭引起的血流动力学变化,可导致肠道的形态、通透性、功能以及肠道菌群的生长和组成发生改变,进而破坏肠道屏障,出现微生物或内毒素移位,加剧全身炎症反应[57-58]。由于内脏灌注不足而导致的所有病理生理改变,均可能导致肠道菌群失调[59]。
5. 小结与展望
生理状态下,肠道微生态在维持人体血流动力学稳定方面具有重要作用。重症患者常出现肠道微生态紊乱,但临床上常忽视这一问题带来的后果。肠道微生态紊乱从多个方面影响着机体血流动力学的稳定,同时,血流动力学不稳定又可进一步加剧肠道微生态紊乱。虽然经过学者多年努力,已发现肠道微生态和血流动力学之间的一些规律,但目前仍不能完全明确二者之间的具体作用机制。未来,随着高通量测序技术的应用和普及,相信对肠道微生态在人体血流动力学中作用机制的认识会越来越深入。
-
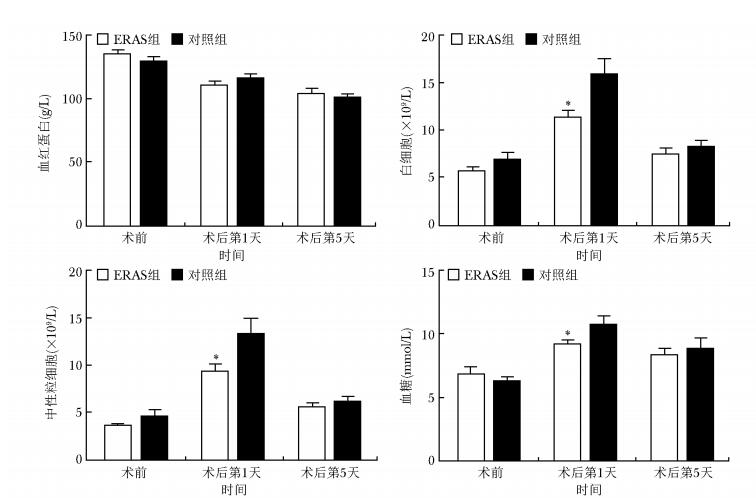
图 1 两组开腹胰十二指肠切除术患者术前与术后早期外周血炎症指标比较
ERAS:同表 1;*两组差异具有统计学意义(P<0.05)
表 1 两组开腹胰十二指肠切除术患者麻醉与多模式镇痛治疗方案
时间/方案 ERAS组 对照组 术前 麻醉评估 术前麻醉门诊评估心肺功能,指导调整术前用药,消除紧张焦虑;使用呼吸功能锻炼仪训练,持续至出院 术前1 d访视住院患者,评估心肺功能 胃肠道准备 无胃肠道动力障碍者术前禁食4 h,禁水2 h,术前2~4 h口服12.6%果糖+麦芽糊精200 ml 术前禁食水8 h 术中 麻醉方案 全麻复合胸段硬膜外镇痛(行T 7~9胸段硬膜外穿刺置管),术中0.33%罗哌卡因4~6 ml/h持续泵入;丙泊酚镇静(靶控输入2~4 μg/ml,维持脑电双频指数于50左右),辅以芬太尼、瑞芬太尼镇痛;吸入50% O2+50%空气 全麻,吸入七氟醚与50% O2+50%笑气混合气体(最低肺泡有效浓度0.8~1.3),辅以芬太尼、瑞芬太尼镇痛 体温保护 入室至离开恢复室全程使用温毯机,使用加温冲洗液及静脉输注液体,调整手术室温度,并监测体温 不进行主动保温 目标导向液体治疗 入室后放置动脉导管,监测脉压变异量以指导术中输液,如果脉压变异量>13%或血压低于基础值的30%,则在5 min内输液泵背景输注3 ml/kg乳酸钠林格氏液/羟乙基淀粉/琥珀酰明胶,如果脉压变异量仍>10%或血压仍低于基础值的30%,则继续液体冲击,如果冲击2次后血压仍低,则使用血管活性药物 入室后放置动脉导管,监测有创动脉压,依据术中心率、血压变化及手术情况进行液体治疗 多模式镇痛 胸段硬膜外持续镇痛(手术切皮前给予帕瑞昔布40 mg或氟比洛芬酯50 mg;手术切皮前给予氯胺酮20~30 mg;辅以芬太尼、瑞芬太尼镇痛) 术中芬太尼、瑞芬太尼镇痛 预防恶心呕吐 对于术后恶心呕吐Apfel评分中危患者诱导前及手术前30~60 min增加一次血清素受体拮抗剂(昂丹司琼/格拉司琼);对于术后恶心呕吐Apfel评分高危患者,手术结束前30~60 min予血清素受体拮抗剂和胃复安25~50 mg 所有患者诱导时予地塞米松及一次血清素受体拮抗剂(昂丹司琼/格拉司琼)预防恶心呕吐 术后 镇痛 0.2%罗哌卡因患者自控硬膜外镇痛;帕瑞昔布40 mg ×每12 h一次,必要时追加镇痛药物(曲马多、羟考酮);维持患者疼痛评分低于2分 0.6 μg/ml舒芬太尼患者自控静脉镇痛,必要时追加镇痛药物(曲马多、羟考酮) ERAS:加速康复外科 表 2 两组开腹胰十二指肠切除术患者一般资料比较
组别 性别(例) 年龄(x±s,岁) BMI(x±s,kg/m2) ASA分级(例) 是否保留幽门(例) 手术时间(x±s,h) 术中失血量(x±s,ml) 男 女 Ⅰ级 Ⅱ级 Ⅲ级 保留 不保留 ERAS组(n=19) 11 8 57.8±2.3 22.4±2.4 3 15 1 5 14 5.4±0.4 671.1±88.8 对照组(n=20) 12 8 51.0±3.0 21.4±4.1 4 12 4 6 14 5.5±0.3 578.5±51.4 P值 0.894 0.077 0.352 0.157 0.798 0.870 0.362 ERAS:同表 1;BMI:体质量指数;ASA:美国麻醉医师协会 表 3 两组开腹胰十二指肠切除术患者术中组织灌注指标及阿片药物暴露比较
组别 术中血流动力学指标 血乳酸浓度(x±s,mmol/L) 术中输液量(x±s,ml) 术中尿量(x±s,ml) 术中芬太尼用量(x±s,μg) 入室收缩压(x±s,mm Hg) 最高收缩压(x±s,mm Hg) 入室心率(x±s,次/min) 最高心率(x±s,次/min) 持续血管活性药支持(例) 入室 出室 晶体 胶体 异体血红细胞 异体血浆 总入量 ERAS组(n=19) 127.0±2.7 143.7±4.0 79.4±2.6 96.2±4.6 8 1.4±0.1 1.6±0.2 3258.0±291.5 1253.0±170.4 273.7±92.0 115.8±41.4 4900.0±453.8 894.7±115.3 234.2±35.3 对照组(n=20) 123.9±5.8 142.4±3.4 79.0±3.7 89.6±2.6 4 1.3±0.1 2.9±0.3 3305.0±193.8 700.0±105.1 200.0±68.1 80.0±39.5 4285.0±295.4 762.5±93.8 450.0±43.4 P值 0.634 0.790 0.926 0.212 0.176 0.539 0.002 0.893 0.008 0.521 0.535 0.259 0.377 0.001 ERAS:同表 1 表 4 两组开腹胰十二指肠切除术患者术后镇痛、早期恢复指标、住院时间及费用比较(x±s)
项目 ERAS组(n=19) 对照组(n=20) P值 术后疼痛VAS评分 术后第1天静息状态 2.1±0.3 1.8±0.3 0.547 术后第2天静息状态 0.8±0.2 1.3±0.3 0.121 术后第1天活动状态 3.1±0.1 3.9±0.3 0.014 术后第2天活动状态 2.4±0.3 3.3±0.3 0.030 镇静评分 0.1±0.1 0.3±0.1 0.323 恶心评分 0.2±0.1 0.7±0.2 0.021 呕吐次数 0.1±0.1 0.6±0.2 0.012 镇痛满意度评分 0.1±0.2 0.6±0.1 0.001 术后阿片药用量(mg) 14.2±5.5 166.0±22.3 0.000 术后恢复指标(d) 拔除气管导管时间 1.0±0.0 1.1±0.1 0.336 导尿管拔除时间 1.2±0.1 1.9±0.2 0.004 胃管拔除时间 1.3±0.2 3.1±0.3 0.000 首次下床活动时间 1.3±0.1 2.0±0.2 0.004 首次排气时间 2.6±0.2 3.8±0.5 0.036 ICU停留时间(d) 1.1±0.1 1.0±0.2 0.447 总住院时间(d) 20.5±1.2 25.4±1.6 0.021 总住院费用(元) 70 799.5±3310.4 76 381.1±9350.5 0.585 ERAS:同表 1;VAS:视觉模拟疼痛评分 -
[1] Wilmore DW, Kehlet H. Management of patients in fast track surgery[J]. BMJ, 2001, 322:473-476. DOI: 10.1136/bmj.322.7284.473
[2] Ljungqvist O, Scott M, Fearon KC. Enhanced Recovery After Surgery:A Review[J]. JAMA Surg, 2017, 152:292-298. DOI: 10.1001/jamasurg.2016.4952
[3] Karran A, Wheat J, Chan D, et al. Propensity score analysis of an enhanced recovery programme in upper gastrointestinal cancer surgery[J]. World J Surg, 2016, 40:1645-1654. DOI: 10.1007/s00268-016-3473-6
[4] Sutherasan M, Taesombat W, Sirichindakul B, et al. Improving the surgical outcomes after liver resection with ERAS program[J]. J Med Assoc Thai, 2017, 100:435-440.
[5] Kent M, Calvert N, Blades K, et al. Enhanced recovery principles applied to revision hip and knee arthroplasty reduces length of stay and blood transfusion[J]. J Orthop, 2017, 14:555-560. DOI: 10.1016/j.jor.2017.08.012
[6] Tan NLT, Hunt JL, Gwini SM. Does implementation of an enhanced recovery after surgery program for hip replacement improve quality of recovery in an Australian private hospital:a quality improvement study[J]. BMC Anesthesiol, 2018, 18:64. DOI: 10.1186/s12871-018-0525-5
[7] Barber EL, Van Le L. Enhanced recovery pathways in gynecology and gynecologic oncology[J]. Obstet Gynecol Surv, 2015, 70:780-792. DOI: 10.1097/OGX.0000000000000259
[8] Collins JW, Patel H, Adding C, et al. Enhanced recovery after robot-assisted radical cystectomy:EAU robotic urology section scientific working group cnsensus view[J]. Eur Urol, 2016, 70:649-660. DOI: 10.1016/j.eururo.2016.05.020
[9] Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy:Enhanced Reco-very After Surgery (ERAS(R)) Society recommendations[J]. Clin Nutr, 2012, 31:817-830. DOI: 10.1016/j.clnu.2012.08.011
[10] Liu Z, Peneva IS, Evison F, et al. Ninety day mortality following pancreatoduodenectomy in England:has the optimum centre volume been identified?[J]. HPB (Oxford), 2018. doi: 10.1016/j.hpb.2018.04.008.[Epub ahead of print].
[11] Das BC, Khan AS, Elahi NE, et al. Morbidity and mortality after pancreatoduodenectomy:a five year eperience in Bangabandhu Sheikh Mujib Medical University[J]. Mymensingh Med J, 2017, 26:145-153.
[12] Amini A, Patanwala AE, Maegawa FB, et al. Effect of epidural analgesia on postoperative complications following pancreaticoduodenectomy[J]. Am J Surg, 2012, 204: 1000-1004, discussion 4-6.
[13] Hutchins JL, Grandelis AJ, Kaizer AM, et al. Thoracic paravertebral block versus thoracic epidural analgesia for post-operative pain control in open pancreatic surgery:A randomized controlled trial[J]. J Clin Anesth, 2018, 48:41-45. DOI: 10.1016/j.jclinane.2018.04.013
[14] Gerritsen A, Besselink MG, Gouma DJ, et al. Systematic review of five feeding routes after pancreatoduodenectomy[J]. Br J Surg, 2013, 100: 589-598, discussion 99.
[15] Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy:Enhanced Recovery After Surgery (ERAS(R)) Society recommendations[J]. World J Surg, 2013, 37:240-258. DOI: 10.1007/s00268-012-1771-1
[16] Mezhir JJ. Management of complications following pancreatic resection:an evidence-based approach[J]. J Surg Oncol, 2013, 107:58-66. DOI: 10.1002/jso.23139
[17] Agarwal A, Pandey R, Dhiraaj S, et al. The effect of epidural bupivacaine on induction and maintenance doses of propofol (evaluated by bispectral index) and maintenance doses of fentanyl and vecuronium[J]. Anesth Analg, 2004, 99: 1684-1688, table of contents.
[18] Mcevoy MD, Scott MJ, Gordon DB, et al. American Society for Enhanced Recovery (ASER) and Perioperative Quality Initiative (POQI) joint consensus statement on optimal analgesia within an enhanced recovery pathway for colorectal surgery:part 1-from the preoperative period to PACU[J]. Perioper Med (Lond), 2017, 6:8. DOI: 10.1186/s13741-017-0064-5
[19] Long DR, Lihn AL, Friedrich S, et al. Association between intraoperative opioid administration and 30-day readmission:a pre-specified analysis of registry data from a healthcare network in New England[J]. Br J Anaesth, 2018, 120:1090-1102. DOI: 10.1016/j.bja.2017.12.044
[20] Du KN, Feng L, Newhouse A, et al. Effects of Intraoperative Opioid Use on Recurrence-Free and Overall Survival in Patients With Esophageal Adenocarcinoma and Squamous Cell Carcinoma[J]. Anesth Analg, 2018, 127:210-216. DOI: 10.1213/ANE.0000000000003428
[21] Daudel F, Ertmer C, Stubbe HD, et al. Hemodynamic effects of thoracic epidural analgesia in ovine hyperdynamic endotoxemia[J]. Reg Anesth Pain Med, 2007, 32:311-316. DOI: 10.1097/00115550-200707000-00007
[22] Radovanovic D, Radovanovic Z, Skoric-Jokic S, et al. Thoracic Epidural Versus Intravenous Patient-Controlled Analg-esia after Open Colorectal Cancer Surgery[J]. Acta clinica Croatica, 2017, 56:244-254.
[23] Lee JH, Park JH, Kil HK, et al. Efficacy of intrathecal morphine combined with intravenous analgesia versus thoracic epidural analgesia after gastrectomy[J]. Yonsei Med J, 2014, 55:1106-1114. DOI: 10.3349/ymj.2014.55.4.1106
[24] Partelli S, Crippa S, Castagnani R, et al. Evaluation of an enhanced recovery protocol after pancreaticoduodenectomy in elderly patients[J]. HPB (Oxford), 2016, 18:153-158. DOI: 10.1016/j.hpb.2015.09.009
[25] Koller SE, Bauer KW, Egleston BL, et al. Comparative Effectiveness and Risks of Bowel Preparation Before Elective Colorectal Surgery[J]. Ann Surg, 2018, 267:734-742. DOI: 10.1097/SLA.0000000000002159
[26] Lavu H, Kennedy EP, Mazo R, et al. Preoperative mech-anical bowel preparation does not offer a benefit for patients who undergo pancreaticoduodenectomy[J]. Surgery, 2010, 148:278-284. DOI: 10.1016/j.surg.2010.03.012
[27] Singh BN, Dahiya D, Bagaria D, et al. Effects of preo-perative carbohydrates drinks on immediate postoperative outcome after day care laparoscopic cholecystectomy[J]. Surg Endosc, 2015, 29:3267-3272. DOI: 10.1007/s00464-015-4071-7
[28] Bernard H. Patient warming in surgery and the enhanced recovery[J]. Br J Nurs, 2013, 22:319-320, 322-325. DOI: 10.12968/bjon.2013.22.6.319
[29] Gustafsson UO, Scott MJ, Schwenk W, et al. Guidelines for perioperative care in elective colonic surgery:Enhanced Recovery After Surgery (ERAS(R)) Society recommenda-tions[J]. Clin Nutr, 2012, 31:783-800. DOI: 10.1016/j.clnu.2012.08.013
[30] Kwaan MR, Lee JT, Rothenberger DA, et al. Early removal of urinary catheters after rectal surgery is associated with increased urinary retention[J]. Dis Colon Rectum, 2015, 58:401-405. DOI: 10.1097/DCR.0000000000000317
-
期刊类型引用(8)
1. 胡春华,赵晓艳,吴黎黎,陈红芽,许鑫,王古岩. 术中多模式镇痛对终末期头颈部癌症患者开腹胃造瘘术后早期恢复质量的影响:前瞻性随机对照研究. 协和医学杂志. 2024(02): 359-365 .  本站查看
本站查看
2. 安欣璨,赵磊,曹峰,尹春琳,薛张纲,陆智杰,孟庆涛,王锷,徐桂萍,王月兰,雷迁,王天龙. 合并多系统疾病老年患者腹腔镜胰十二指肠切除术的麻醉与围术期管理. 中华麻醉学杂志. 2023(07): 880-883 .  百度学术
百度学术
3. 黄重峰,刘毅,程小玲,焦丰,吴文鴶,李铨华. 基于加速康复外科理念的多模式麻醉管理在胸腔镜肺叶切除术围手术期的临床效果. 中国当代医药. 2023(32): 106-109+113 .  百度学术
百度学术
4. 张树彬,周新博,胡子轩,邢中强,刘建华. 加速康复外科理念指导腹腔镜肝巨大血管瘤剥除术疗效. 中华肝脏外科手术学电子杂志. 2022(06): 601-606 .  百度学术
百度学术
5. 张蕊霞,洪蕾,苏敏君,张楠. 快速康复外科理论下多模式镇痛对腹腔镜全子宫切除术患者应激反应及疼痛的影响. 中国社区医师. 2021(08): 51-52+55 .  百度学术
百度学术
6. 郭强,钟锴,蒋铁民,冉博,张瑞青,杨鹏,宋涛,吐尔干艾力·阿吉,邵英梅. 加速康复外科理念在胰十二指肠切除术围手术期中的疗效分析. 中华普外科手术学杂志(电子版). 2020(03): 252-255 .  百度学术
百度学术
7. 严晓艳. 快速康复理念下腹腔镜胰十二指肠切除术患者多模式镇痛的护理研究. 心理月刊. 2019(11): 118 .  百度学术
百度学术
8. 钟锴,邵英梅. 加速康复外科在胰十二指肠切除术围手术期中的运用. 新疆医学. 2019(09): 857-859+863+849 .  百度学术
百度学术
其他类型引用(5)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS

 下载:
下载:
