-
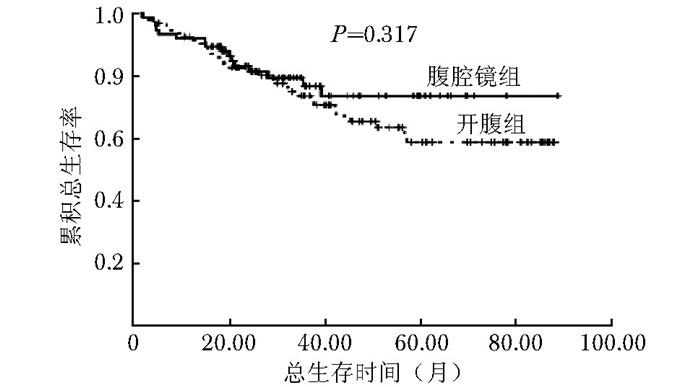
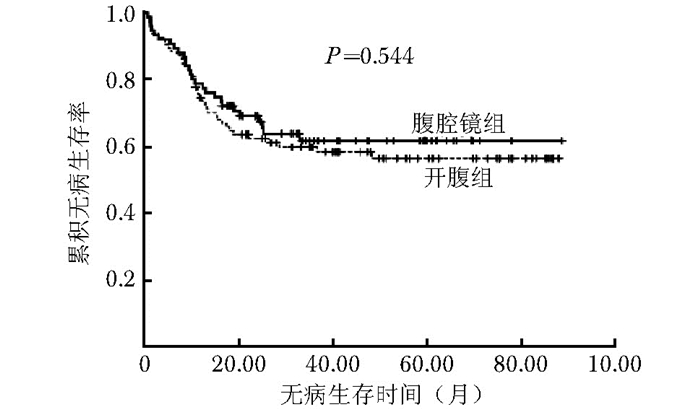
摘要:目的 评价腹腔镜结肠癌根治性切除术治疗Ⅲ期结肠癌患者的临床疗效和长期预后。方法 2007年1月至2012年12月北京协和医院基本外科结直肠专业组收治的169例Ⅲ期结肠癌患者分为腹腔镜组75例和开腹组94例。比较两组患者的临床病理特征以及5年局部复发率、总生存率和无病生存率等长期预后结果。结果 腹腔镜组手术时间显著长于开腹组[(171.3±43.2)min比(132.7±60.4)min, P < 0.001], 但是术中出血量较少[(86.3±61.7)ml比(109.8±74.6)ml, P=0.030]。腹腔镜组检出淋巴结数目显著多于开腹组(23.3±12.2比19.3±9.6, P=0.022)。腹腔镜组和开腹组患者的累积局部复发率分别为6.7%和8.5%;5年总生存率分别为73.6%和58.8%;5年无病生存率分别为61.6%和56.3%;两组差异均无统计学意义(P > 0.05)。结论 腹腔镜手术对于治疗Ⅲ期结肠癌安全可行, 其长期肿瘤学疗效不劣于传统开腹手术。Abstract:Objective To investigate the clinical efficacy and long-term outcomes of laparoscopic radical resection for stage Ⅲ colon cancer.Methods A total of 169 stage Ⅲ colon cancer patients treated with laparoscopic surgery (n=75) or open surgery (n=94) between January 2007 and December 2012 in Department of General Surgery, Peking Union Medical College Hospital were included. The clinicopathologic features, as well as long-term outcomes including 5-year local recurrence rate, overall survival, and disease-free survival, were compared between the two groups.Results Compared with the open surgery group, the laparoscopic surgery group had significantly longer operation time[(171.3±43.2) minutes vs. (132.7±60.4) minutes, P < 0.001], significantly less blood loss[(86.3±61.7)ml vs. (109.8±74.6)ml, P=0.030], and significantly more invaded lymph nodes detected (23.3±12.2 vs. 19.3±9.6, P=0.022). No significant difference was found between the laparoscopic surgery group and open surgery group in cumulative local recurrence rate (6.7% vs. 8.5%, P=0.876), 5-year overall survival (73.6% vs. 58.8%, P=0.317), and 5-year disease-free survival (61.6% vs. 56.3%, P=0.544).Conclusion Laparoscopic colectomy is safe and effective for stage Ⅲ colon cancer, comparable with the conventional open colectomy in terms of long-term oncological outcomes.
-
Keywords:
- stage Ⅲ colon cancer /
- laparoscopic surgery /
- outcome analysis
-
复杂肾血管平滑肌脂肪瘤(angiomyolipoma, AML)治疗难度大, 包括孤立肾或相对孤立肾合并AML[1]、多发AML[2]、巨大AML(肿瘤最大直径>7 cm)[3]、紧邻肾集合系统或肾门的AML[4]、既往有出血破裂造成严重粘连的肾AML[5]。这类肾AML手术风险高, 缺乏大宗病例报道, 手术方式的选择尚不明确。本文回顾北京协和医院收治的14例复杂肾AML患者的临床资料和外科治疗措施, 分析其手术方式的选择策略及围手术期处理原则。
1. 对象与方法
1.1 研究对象
2015年1月至2018年3月在北京协和医院泌尿外科住院接受外科治疗并经病理检查确诊为复杂肾AML的患者。
纳入标准:(1)孤立肾或相对孤立肾合并AML; (2)多发AML; (3)巨大AML(肿瘤最大直径>7 cm); (4)紧邻肾集合系统或肾门的AML; (5)既往有出血破裂史造成严重粘连的AML。
排除标准:除外以上5点的肾AML以及其他类型肾占位患者。
1.2 观察指标
收集并整理完成临床随访的患者资料, 包括年龄、性别、BMI、病程、肿瘤大小、肿瘤部位、术式选择、手术时间、肾脏热缺血时间、术中出血量、术前及术后1个月血肌酐变化情况等。
收集患者术前及术后CT影像, 观察肿瘤切除情况、有无复发、肾脏形态及血流变化。
1.3 手术治疗
1.3.1 手术方式选择
复杂肾AML手术难度大, 本组病例均先行腹膜后腹腔镜肾脏探查术, 待游离好需阻断的肾动脉后, 如探查结果提示腹腔镜手术困难则改为开放手术。肾AML为肾脏良性肿瘤, 保留肾单位肾部分切除及肿瘤剜除术为备选手术方式, 根据肿瘤基底与肾实质的关系决定术式选择, 如基底较浅可行肾脏部分切除术, 如基底深且紧邻肾脏集合系统或肾门可行肿瘤剜除术。
1.3.2 腹腔镜手术操作
全麻后患者取健侧卧位, 分别于腋中线髂棘上2 cm处(A点)、腋后线十二肋下(B点)、腋前线十二肋下(C点)、与A-C连线呈等边三角形临近腹膜反折处(D点)置入10、12、10、5 mm Trocar各一枚(图 1)。建立气腹, B点置入观察镜, 游离腹膜外脂肪, 打开侧锥筋膜, 延腰大肌表面游离分离肾脏背侧, 寻找肾动脉并打开动脉鞘, 使用直角钳游离出肾动脉主干约2 cm。充分游离肾脏并尽可能游离肿瘤周边, 仔细辨别肿瘤与肾实质界限(图 2)。使用血管夹夹闭肾动脉并计时, 行肾脏部分切除或结合吸引器行肿瘤剜除术(图 3), 使用事先做好的尾部有Hem-o-lock的3-0 V-lock线及1-0 V-lock线分别缝合肾脏创面基底及贯穿缝合创面(图 4), 最后一针出针点选择有包膜的肾实质表面, 夹毕Hem-o-lock并拉紧V-lock线, 去除血管夹, 观察创面无出血后, 进一步完整分离之前难以游离的全部肿瘤边界, 完整切除肿瘤并取出, 留置肾周引流管。
1.3.3 开放手术操作
先行腹腔镜肾脏探查, 步骤同上, 寻找肾动脉并尽可能游离肾脏及肿瘤后, 转为开放手术。选择经腰部十二肋下切口, 打开腰背部肌肉及腰背筋膜, 进入肾周脂肪囊内, 将肾脏及肿瘤向下游离, 使用血管夹夹闭肾动脉并计时, 用电刀行保留肾单位手术或电刀结合吸引器行肿瘤剜除术, 使用3-0 V-lock线及1-0 V-lock线分别缝合肾脏创面基底及贯穿缝合创面, 最后一针出针点选择有包膜的肾实质表面, 夹毕Hem-o-lock并拉紧V-lock线, 去除血管夹, 观察创面无出血后, 留置肾周引流管并关闭切口。
1.4 病理检查
所有标本经福尔马林固定后送病理检查, 行HE染色。免疫组化标记采用SP法, 标记物分别为抗Vimentin、CK、EMA、HMB45、MelanA、SMA、CgA、S-100。
1.5 随访
所有患者随访2~35个月, 术后1个月及每6个月抽血检查肾功能并行腹盆CT平扫或增强扫描。
1.6 统计学处理
采用SPSS 22.0统计软件处理数据。计量资料采用方差分析检验数据是否符合正态分布, 符合正态分布者采用均数±标准差表示, 不符合正态分布者采用中位数表示。手术前后数据对比采用配对t检验。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
14例复杂肾AML患者符合入选和排除标准, 男性5例, 女性9例, 年龄18~48岁, 中位年龄41岁, 肿瘤最大直径0.5~22.0 cm(图 5)。其中4例患者为左肾AML(图 6), 3例右肾AML(图 7), 7例双肾AML(其中5例患者经基因诊断明确为结节性硬化症, 图 8), 相对孤立肾1例, 巨大AML 8例(图 9), 6例为紧邻肾集合系统或肾门部的AML(图 10), 2例合并出血破裂史, 合并出血破裂史的AML患者术前有突发腰背部剧烈疼痛、血尿等表现。7例患者合并2种及以上复杂AML。
2.2 手术情况
14例患者手术均顺利完成, 其中6例行腹腔镜保留肾单位手术, 5例行腹腔镜肿瘤剜除术, 3例行腹腔镜转开放手术。手术时间为60~150 min, 平均(97± 26)min; 热缺血时间为14~40 min, 平均(25±7)min; 术中出血量10~450 ml, 平均(125±113)ml, 均未予输血。
2.3 肾功能检测
14例患者术前血肌酐水平55~150 μg/ml, 平均(84.1±26.8)μg/ml; 术后1个月血肌酐水平62~210 μg/ml, 平均(97.5±37.0)μg/ml, 两组数据无统计学差异(t=-3.193, P>0.05)。
2.4 影像学检查
14例患者术后均于门诊规律随诊, 接受CT平扫或增强扫描检查, 目前未见肿瘤复发, 治疗效果满意(图 11)。
2.5 病理检查
肿瘤切除标本送病理检查, 所有标本符合血管平滑肌脂肪瘤诊断。显微镜下示肿瘤由梭形和胞质丰富的上皮样平滑肌细胞、多少不等的成熟脂肪组织以及异常厚壁血管三种成分混合构成(图 12)。免疫组化结果显示, 抗Vimentin、HMB45、MelanA、SMA阳性, CK、EMA、CgA及S-100均为阴性。其中1例患者结节性硬化症诊断明确, 增强CT提示双肾多发AML, 先行腹腔镜右肾部分切除术, 术后恢复良好后, 3个月后再行左侧腹腔镜转开放保留肾单位切除术, 切除左肾肿瘤6枚(图 13)。
2.6 随访
术后无感染、血尿、尿漏、少尿及迟发型出血并发症。所有患者随访2~35个月, 未发现肿瘤复发。
3. 讨论
肾AML又称肾错构瘤, 是肾脏常见良性肿瘤, 由脂肪组织、平滑肌组织及不成熟血管这三种成分以不同比例构成, 其构成血管属不成熟畸形血管, 缺乏弹性, 多呈动脉瘤样改变[6]。
肾AML占全部肿瘤的1%~2%, 瘤体过大时受轻微外力冲击或无诱因即可发生破裂出血[7], 当瘤体最直大径>4 cm时发生自发性破裂出血的几率显著增加[8]。瘤体最大直径<4 cm者需定期复查B超, 如出现进展性增大、瘤体最大直径>4 cm或出现腰疼、血尿、腹部触及肿块时, 需要外科干预, 可行保留肾单位手术治疗, 如选择性介入动脉栓塞术、肾肿瘤剜除术或肾部分切除术[9]。
结节性硬化症为肿瘤抑制基因TSC1(9q34)和/或TSC2(16p13)突变引起mTOR信号通路过度活化所致, 1/3患者有家族遗传史, 2/3为新发突变, 约80%患者伴发肾AML[10], 这类患者一般发病年龄小, 双肾多发肿瘤, 瘤体较大, 肾单位破坏严重, 肿瘤进展快且持续, 治疗应侧重解除/减轻肿瘤引起的不适, 预防肿瘤自发性破裂, 尽可能保护肾功能, 综合考虑临床症状、肿瘤大小及数目、进展速度、是否破裂出血、肾功能情况以及恶变可能性等因素[11]。结节性硬化症患者的肿瘤多为双肾多发良性病变, 原则上尽量避免肾切除[12-13]。
典型肾AML含较多脂肪组织, 超声图像中表现为强回声或中强回声, CT图像中呈极低密度值, 随着超声和CT检查的普及, 绝大多数经典肾AML可在术前明确定性诊断[14]。
针对相对孤立、压迫症状明显、无明确供血动脉主支且位于肾脏上下级或外侧缘的表浅病灶, 手术切除效果较好[15]。采用腹腔镜手术切除较大肾AML时, 如瘤体破裂出血, 常由于出血难以控制而致中转开放手术, 如勉强继续行腹腔镜手术, 会因出血致手术视野模糊, 易造成二次损伤, 故对较大肾AML行开放保留肾单位手术是主要选择[16], 针对肾良性肿瘤肾部分切除较根治性肾切除具明显优势[17]。
本组14例均为复杂肾AML, 其中7例患者合并2种及以上AML。针对此类复杂肾AML, 本中心经验为先行腹膜后腹腔镜探查, 紧贴腰大肌表面寻找肾动脉并游离出足够置入阻断夹的空间, 紧贴肾脏表面游离肾脏并寻找肿瘤基底, 尽可能少游离、少触碰瘤体, 结合术前影像学检查和术中探查所见判断可否继续行腹腔镜手术, 如可以则阻断肾动脉后肾部分切除或肿瘤剜除术, 缝合完毕并恢复血运后, 沿肿瘤假包膜游离全部瘤体; 如肿瘤体积过大、基底过宽或肿瘤多发, 使用腹腔镜切除及缝合会延长血运阻断时间, 应主动改为经腰切口开放手术, 行肾部分切除或肿瘤剜除术。对瘤体巨大或肾脏背侧AML患者, 需更早一步游离瘤体, 可考虑经Gerota筋膜外游离肿瘤, 在Gerota筋膜保护下腔镜器械无法直接触碰瘤体, 减少出血机会。术前仔细阅片, 了解肿瘤基底位置、肾动脉主干及分支分布情况, 提前制定游离范围, 预估出血风险, 对腹腔镜复杂肾AML手术具有重要指导意义。娴熟的缝合技术是避免血运恢复后出血及术后出血的重要条件, 采用3-0 V-lock线对基底做编织状缝合, 进出针需果断, 缝合一切可疑血管断端或肾集合系统破损处。
综上所述, 复杂肾AML治疗难度大, 肾脏部分切除或肿瘤剜除术效果确切, 可最大限度保留肾单位, 手术安全有效。根据患者情况制定个体化综合治疗策略, 在熟练操作的技术前提下, 腹腔镜手术可用于治疗复杂肾AML。
-
表 1 Ⅲ期结肠癌患者临床病理特征
组别 性别(例) 年龄
(x±s,岁)术式(例) 手术时间
(x±s,min)出血量
(x±s,ml)组织分化程度(例) 淋巴结获取数目
(x±s)T分期(例) N分期(例) TNM分期(例) 男 女 右半结肠
切除术横结肠
切除术左半结肠
切除术乙状结肠
切除术高 中 低 T2 T3 T4 N1 N2 Ⅲa Ⅲb Ⅲc 腹腔镜组(n=75) 39 36 63.6±13.3 45 3 5 22 171.3±43.2 86.3±61.7 16 47 12 23.3±12.2 4 60 11 51 24 3 56 16 开腹组(n=94) 53 41 63.8±12.6 43 5 13 32 132.7±60.4 109.8±74.6 10 68 16 19.3±9.6 3 82 9 60 34 2 67 25 P值 0.680 0.929 0.341 <0.001 0.030 0.157 0.022 0.441 0.686 0.596 表 2 Ⅲ期结肠癌患者术后复发、转移情况(例)
组别 局部复发 远处转移 吻合口 腹腔内 总计 肝 骨 肺 脑 卵巢 腹膜后 总计 腹腔镜组(n=75) 0 5 5 15 1 3 1 0 1 21 开腹组(n=94) 1 7 8 21 2 5 0 1 2 29 -
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63:11-30. DOI: 10.3322/caac.21166
[2] 万德森.我国结直肠癌的流行趋势及对策[J].中华肿瘤杂志, 2011, 33:481-483. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhzl201107001 [3] 肖毅, 邱辉忠, 吴斌, 等, 腹腔镜下根治性右半结肠切除术的手术效果和肿瘤学疗效[J].中华外科杂志, 2014, 52:249-253. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhwk201404003 [4] Wang CL, Qu G, Xu HW, et al. The short- and long-term outcomes of laparoscopic versus open surgery for colorectal cancer:a meta-analysis[J]. Int J Colorectal Dis, 2014, 29:309-320. DOI: 10.1007/s00384-013-1827-1
[5] Fleshman J, Sargent DJ, Green E, et al. Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the COST Study Group trial[J]. Ann Surg, 2007, 246:655-662. DOI: 10.1097/SLA.0b013e318155a762
[6] Guillou PJ, Quirke P, Thorpe H, et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial):multicentre, randomised controlled trial[J]. Lancet, 2005, 365:1718-1726. DOI: 10.1016/S0140-6736(05)66545-2
[7] Berends FJ, Kazemier G, Bonjer HJ, et al. Subcutaneous metastases after laparoscopic colectomy[J]. Lancet, 1994, 344:58. http://www.sciencedirect.com/science/article/pii/S0140673694910790
[8] Johnson PM, Porter GA, Ricciardi R, et al. Increasing negative lymph node count is independently associated with improved long-term survival in stage ⅢB and ⅢC colon cancer[J]. J Clin Oncol, 2006, 24:3570-3575. DOI: 10.1200/JCO.2006.06.8866
[9] Hong KD, Lee SI, Moon HY. Lymph node ratio as determined by the 7th edition of the American Joint Committee on Cancer staging system predicts survival in stage Ⅲ colon cancer[J]. J Surg Oncol, 2011, 103:406-410. DOI: 10.1002/jso.21830
[10] Lykke J, Roikjaer O, Jess P. The relation between lymph node status and survival in Stage Ⅰ-Ⅲ colon cancer:results from a prospective nationwide cohort study[J]. Colorectal Dis, 2013, 15:559-565. DOI: 10.1111/codi.12059
[11] Lee JE, Joh YG, Yoo SH, et al. Long-term outcomes of laparoscopic surgery for colorectal cancer[J]. J Korean Soc Coloproctol, 2011, 27:64-70. DOI: 10.3393/jksc.2011.27.2.64
[12] Balli JE, Franklin ME, Almeida JA, et al. How to prevent port-site metastases in laparoscopic colorectal surgery[J]. Surg Endosc, 2000, 14:1034-1036. DOI: 10.1007/s004640000223
[13] Lacy AM, Delgado S, Castells A, et al.The long-term results of a randomized clinical trial of laparoscopy-assisted versus open surgery for colon cancer[J]. Ann Surg, 2008, 248:1-7. DOI: 10.1097/SLA.0b013e31816a9d65
[14] Jacob BP, Salky B. Laparoscopic colectomy for colon adenocarcinoma:an 11-year retrospective review with 5-year survival rates[J]. Surg Endosc, 2005, 19:643-649. DOI: 10.1007/s00464-004-8921-y
-
期刊类型引用(1)
1. 殷文兵,张海青,徐寅生,汪大武. 磁共振T_2信号强度联合ADC值鉴别肾透明细胞癌与乏脂型肾血管平滑肌脂肪瘤. 中国CT和MRI杂志. 2022(12): 109-111 .  百度学术
百度学术
其他类型引用(1)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS


 下载:
下载: