Effect of Surgical Resection of Isolated Metastasis from Renal Cell Carcinoma after Targeted Therapy
-
摘要:目的 探讨靶向药物治疗的转移性肾细胞癌患者远处孤立转移病灶行手术切除的疗效。方法 回顾性收集2007年12月至2013年12月在北京协和医院接受靶向药物治疗的126例转移性肾细胞癌患者资料, 其中16例对远处孤立转移灶予以手术切除。患者均有明确的肾细胞癌病理诊断, 口服靶向药物索拉非尼、舒尼替尼或依维莫司, 直至孤立转移灶稳定且评估为可切除。对手术治疗的安全性和远期效果进行评价。结果 接受远处孤立转移灶切除术的16例患者中, 男11例, 女5例, 中位年龄51岁(37~72岁); 其中肾透明细胞癌14例, 肾乳头状细胞癌2例; 肺转移5例, 骨转移2例, 肾上腺转移5例, 脑转移2例, 肝转移1例, 腹壁转移1例。患者围术期均恢复良好, 无严重并发症发生。术后肿瘤相关症状明显缓解, 一般情况有所好转。16例患者1、3、5年生存率分别为75.0%、43.8%和31.3%。无手术相关的死亡。结论 经靶向药物治疗的晚期肾细胞癌患者有远处孤立转移灶时可从手术治疗中获益, 取得较长时间生存。Abstract:Objective To evaluate the effect of surgical resection of isolated metastases in patients with advanced renal cell carcinoma after targeted therapy.Methods Data were retrospectively collected from 126 patients with metastatic renal cell carcinoma who received targeted therapy in Peking Union Medical College Hospital between December 2007 to December 2013, of whom 16 underwent surgery for distant isolated metastases. All the patients had a confirmed pathological diagnosis of renal cell carcinoma. The targeted therapy involved taking oral drugs including Sorafenib, Sutent, or Everolimus continuously until the isolated metastases were evaluated as stable and resectable. Safety and long-term effect of surgical resection were evaluated.Results The 16 patients included 11 males and 5 females with a median age of 51 (37-72) years. Fourteen cases were renal clear cell carcinomas and 2 were renal papillary cell carcinomas; lung metastasis was found in 5 cases, bone metastasis in 2 cases, adrenal metastasis in 5 cases, brain metastasis in 2 cases, liver metastasis in 1 case, and abdominal wall metastasis in 1 case. In the perioperative period, all the patients recovered well without serious complications. Tumor-related symptoms were relieved after the surgery and the general situation was improved. The 1-, 3-, and 5-year survival of the 16 patients were 75.0%, 43.8%, and 31.3%, respectively. There was no surgery-related mortality.Conclusion Patients with renal cell carcinoma treated with targeted therapy who develop distant isolated metastases may benefit from surgical resection of the metastases, achieving reasonable long-term survival.
-
Keywords:
- renal cell carcinoma /
- isolated metastasis /
- surgical resection /
- long-term survival
-
肾细胞癌的发病率逐年升高,2014年美国约有63 920例新诊断病例,诊断时中位年龄为65岁,约13 860例患者死亡[1]。在过去60年间,肾细胞癌发病率每年增长2%。晚期肾细胞癌多转移至肺、骨、脑、肝和肾上腺[2]。约30%的局限性肾细胞癌患者在术后发生转移,其预后较差,5年生存率<10%[3]。但是经过靶向药物治疗,大多数患者转移病灶部分缓解或稳定,如果进一步对孤立转移灶采取合适的手术方式切除,可降低肿瘤负荷,避免致残或骨折,减少疼痛,使部分患者获得更长的疾病无进展生存期。在北京协和医院接受靶向药物治疗的转移性肾细胞癌患者中,部分患者行远处孤立转移病灶切除术,术后继续药物治疗,本研究对转移灶切除手术的疗效和安全性进行评价。
资料和方法
临床资料
回顾性收集2007年12月至2013年12月北京协和医院泌尿外科接受靶向药物治疗的126例转移性肾细胞癌患者资料,其中16例患者接受远处孤立转移灶切除手术。所有患者均有明确的肾细胞癌病理诊断,口服靶向药物治疗,直至肿瘤进展或孤立转移灶稳定且评估为可切除。
治疗方案
所有患者先口服索拉菲尼、舒尼替尼或依维莫司中一种靶向药物,可空腹或在餐中服用,避免与高脂饮食同时服用。如出现药物相关的不良反应,可降低剂量。每8周行螺旋CT评估。对于完全缓解或部分缓解和疾病稳定的患者,切除孤立转移灶后继续服用靶向药物,定期随访。如果疾病进展,将停用药物并进行生存期随访。
术前评估可手术条件
按实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)有可测量病灶(至少有一条可测量径线,且最长径≥20 mm,或螺旋CT扫描最长径≥10 mm);年龄≥18岁;东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态为0、1或2;具有较好的骨髓功能和肝肾功能。
疗效评估
术前及术后随访采用CT、磁共振成像等影像学手段按RECIST标准进行疗效评价。在给药前3周内进行相关检查评估并作为基线结果。在治疗期,通过采集病史、体格检查和实验室检查进行安全性评估,安全性分析基于所有至少接受过1次靶向药物治疗及接受手术治疗的患者。评估转移灶切除手术围术期的安全性。
结果
一般情况
接受靶向药物治疗的126例转移性肾细胞癌患者中,男89例,女37例,平均年龄59.8岁(42~81岁)。ECOG体能状态评分0分者52例,1分者51例,2分者23例。纪念斯隆凯特琳癌症中心(Memorial Sloan-Ketterlin Cancer Center,MSKCC)评分:低危患者10例,中危患者85例,高危患者31例。主要转移部位为肺(n=93)、骨(n=19)、淋巴结(n=15)、肝脏(n=12)、脑(n=12)和肾上腺(n=11)等;转移灶1个24例,2个39例,3个及以上63例。术前病理87例为透明细胞癌。
接受再次外科治疗切除转移灶的16例患者中,男11例,女5例;中位年龄51岁(37~73岁)。患者既往有肾切除史15例(93.8%),既往接受过免疫治疗4例(25.0%)。伴发疾病:高血压病8例,糖尿病2例。ECOG体能状态评分0分者7例,1分者6例,2分者3例。治疗前MSKCC评分:低中危患者13例,高危患者3例。卡氏功能状态评分(Karnofsky performance score,KPS)均≥90分。Ⅰ度贫血2例,乳酸脱氢酶升高3例。15例在靶向药物治疗前已行肾脏原发肿瘤切除;1例未切除原发灶,穿刺活检取得病理诊断后行靶向治疗长期带瘤生存;从肾切除手术到药物治疗>12个月的患者13例。
肾脏原发肿瘤病理
16例患者肿瘤最大径4.6~14.3 cm,平均8.5 cm。T分期:T1b 4例,T2a 5例,T2b 3例,T3a 2例,T3b 1例,T4 1例;N分期:N0 14例,N1 2例;M分期:M1 16例。病理类型:透明细胞癌14例(87.5%),乳头状细胞癌2例(12.5%);Fuhrman分级:1~2级13例,3级3例。
转移特征及手术情况
16例患者中,初诊肾细胞癌时即有转移者4例,另12例在肾癌根治术后出现转移。从手术至发现转移时间>12个月的患者11例。肺转移5例,行肺局部楔形切除术;骨转移2例,行骨病灶切除及局部固定术;肾上腺转移5例,行腹腔镜肾上腺转移灶切除术;脑转移2例,行颅内转移灶切除术;肝转移1例,行肝部分切除术;腹壁转移1例,行腹壁转移灶切除术。患者围术期均恢复良好,无严重并发症。有颅内转移和骨转移者,压迫症状明显缓解;其余部位转移者,肿瘤负荷减轻,一般情况有所好转。
生存情况
切除孤立转移灶的16例患者中,术后1年内有4例死亡,3年内有9例死亡,5年内共有11例死亡,其中8例肿瘤进展或复发,全身多器官衰竭;2例因心脑血管意外死亡。无手术相关的死亡。患者1、3、5年生存率分别为75.0%、43.8%和31.3%。
典型病例
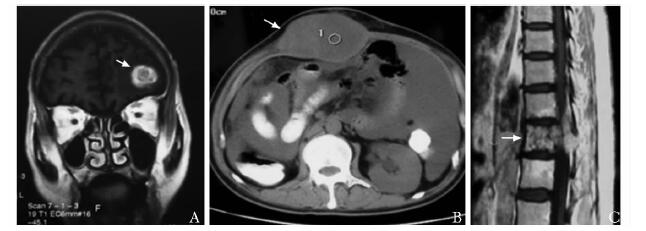
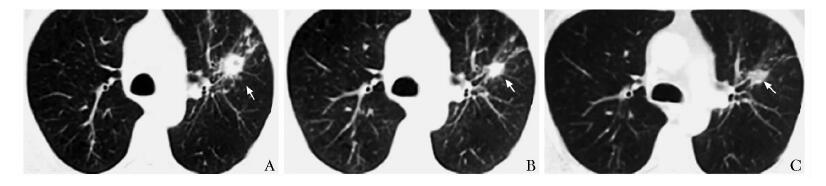
1例患者术后19个月胸部CT提示双肺结节增大;行靶向药物治疗7个月,双肺结节减小;至肺结节进一步减小,强化减低,行肺转移灶楔形切除术(图 1)。3例患者肾细胞癌术后复查,磁共振成像及CT提示分别有脑转移、腹壁转移及椎体转移(图 2),未见其他部位转移,予以靶向药物治疗后行孤立病灶切除,存活超过5年。
讨论
肾脏肿瘤中约90%为肾细胞癌,其中85%为透明细胞癌。其他少见类型包括乳头状细胞癌、嫌色细胞癌和集合管癌(约1%)[4]。美国监测、流行病学及预后(Surveillance, Epidemiology, and End Results,SEER)数据库分析显示局限期肾癌与进展期肾癌的5年生存率逐年提高。5年生存率最重要的预后因子为肿瘤分级、局部侵犯程度、区域淋巴结是否转移和是否有远处转移灶[5]。肾细胞癌对酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)和哺乳动物雷帕霉素受体(mammalian target of rapamycin receptor,mTOR)抑制剂敏感,小部分原发灶和单一孤立转移灶有手术切除可能的患者可以接受手术,包括原发病灶并转移病灶,以及肾癌根治较长时间后出现的孤立复发。目前认为转移灶的手术适用于根治性肾切除术后出现的孤立性转移瘤以及肾癌伴孤立性转移、行为状态良好的患者。可切除的孤立转移灶包括肺、骨、肾上腺和脑。原发灶和转移灶可同时或分次手术切除。大部分行孤立转移灶切除的患者可能出现原发灶或转移灶复发。然而也有报道证实孤立性骨转移切除并接受放疗可以获得长期生存[6]。
近期的大规模观察性研究对转移性肾细胞癌患者是否行手术切除的预后作了多变量分析,发现其预后的独立预测因素包括性别为男性、无病间隔>1年、转移部位单一和完整转移灶切除。患者5年总生存率约29%~31%,中位生存期为4.7年,21%的患者在最后一次随访时状态仍良好。转移灶切除的大多数患者得到部分或完全缓解,骨转移灶切除后仅有25%复发。因此,积极的外科切除术后,一定比例的患者可延长生存期或获得长期生存[7]。肾细胞癌常见转移部位的特点及及治疗后的预后如下:(1)肺转移:Hofmann等[8]发现,高达50%的孤立肺转移患者在切除肺转移病灶后的无瘤生存期长达5年。因此,对仅有单发、孤立可切除转移灶的肾细胞癌患者,如身体状况允许应积极行转移灶切除。肺转移80%~90%为多发性,10%~20%为局限性或孤立性,多在肾癌术后2年内发生转移。肺转移属于晚期,肺转移瘤切除术也可用于再分期和预后判断。需要满足的手术条件包括控制原发肿瘤、能完整切除所有转移、没有胸外转移以及心肺功能足以耐受手术。范围应尽量保守,一般仅作楔形或肺段、肺叶切除术。术后继续给予抗肿瘤药物治疗。无瘤生存期短表明肿瘤恶性程度高,预后差。其他可能的预后因素有转移瘤个数、转移瘤直径、转移瘤的部位(单肺或双肺)、倍增时间、肺门纵隔淋巴结转移、原发肿瘤分期等。(2)骨转移:肾细胞癌骨转移多为溶骨性,易引起病理性骨折或脊髓压迫等并发症,骨转移占肾细胞癌所有转移部位的20%~25%[9],对病理性骨折或伴承重骨有骨折风险的患者,如患者体能状态良好应首选外科手术治疗。Fuchs等[10]报道单发性骨转移患者手术后1、3和5年生存率分别为83%、45%和23%,行扩大性转移病灶切除或局部固定术的患者生存期显著长于单纯行辅助治疗者,手术切除转移病灶不仅可以缓解症状,而且可以显著延长部分患者的生存期。骨转移最有效的治疗方法就是手术切除转移灶。姑息性手术主要用于治疗和预防病理性骨折、缓解脊髓压迫,可达到缓解症状,避免神经损伤、甚至截瘫,保存或恢复肢体功能和膀胱等功能的效果。已经为磁共振成像或正电子发射断层扫描证实的病理性骨折或脊髓压迫症状符合下列条件者应首选手术治疗:(1)预计患者存活期>3个月;(2)体能状态良好;(3)术后能改善患者的生活质量,有助于接受放、化疗和护理。骨转移治疗的主要目标是避免致残,缓解疼痛,提高生活质量。手术应遵循3S(save, short and simple)原则,即“保留功能、手术时间要短和手术要简洁”。术后可应用双膦酸盐类药物治疗高钙血症、缓解骨痛,体外照射放疗主要治疗再发骨转移和多发骨转移,缓解骨痛、恢复功能和防止局部病变快速进展。(3)淋巴结转移:区域淋巴结转移的研究中,Pantuck等[11]发现N1~2M0患者的生存期与N0M1的患者相当,但对于临床N1~2M1患者,行淋巴结切除术者的生存期较未行切除术者延长5个月。(4)脑转移:大约50%的患者有头痛症状,以及常见的恶心、呕吐、肢体肌力减退、共济失调和颅神经麻痹等。部位以大脑中动脉供血区等血运较丰富区域为主(占50%以上),而且容易发生在灰质和白质交界处,以额、颞、顶叶多见,枕叶少见。手术治疗是肾细胞癌脑转移的首选方法。同时对于手术切除困难,或者肿瘤体积大有转移者,可在手术前后配合放疗,提高手术切除率,降低肿瘤复发率。手术切除指征可归纳为:单个脑转移病灶;两个以上的脑转移病灶集中在同一区域,且手术切除不直接带来生命危险者;患者全身情况较好,可以耐受开颅手术者;脑部和肺部均为单个病灶,手术均能完全切除,对于术后选择手术加全脑放疗还是立体定向放射治疗效果更优,目前尚无充分证据。
总之,肾细胞癌转移灶的姑息性外科手术最大的意义在于患者可以从手术治疗中获益,能最有效降低肿瘤负荷,或解除转移病灶所造成的各种症状,增强机体抗肿瘤免疫能力,提高生活质量,延长总生存期,部分患者还可获得长期存活,靶向药物治疗后再手术切除孤立转移灶,继续运用靶向药物的三明治治疗方法,是对肾细胞癌远处转移的再认识,也是提高靶向药物治疗效果的有益补充。
-
-
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64:9-29. DOI: 10.3322/caac.21208
[2] Liu X, Wang J, Sun G. Identification of key genes and pathways in renal cell carcinoma through expression profiling data[J]. Kidney Blood Press Res, 2015, 40:288-297. DOI: 10.1159/000368504
[3] Pantuck AJ, Zisman A, Belldegrun AS. The changing natural history of renal cell carcinoma[J]. J Urol, 2001, 166:1611-1623. DOI: 10.1016/S0022-5347(05)65640-6
[4] Li H, Samawi H, Heng DY. The use of prognostic factors in metastatic renal cell carcinoma[J]. Urol Oncol, 2015, 33:509-516. DOI: 10.1016/j.urolonc.2015.08.003
[5] Howlader N, Noone AM, Krapcho M. SEER Cancer Statistics Review, 1975-2011, National Cancer Institute[EB/OL]. http://seer.cancer.gov/csr/1975_2011/.
[6] De Wolf K, Vermaelen K, De Meerleer G, et al. The potential of radiotherapy to enhance the efficacy of renal cell carcinoma therapy[J]. Oncoimmunology, 2015, 4:e1042198. DOI: 10.1080/2162402X.2015.1042198
[7] Ljungberg B. The role of metastasectomy in renal cell carcinoma in the era of targeted therapy[J]. Curr Urol Rep, 2013, 14:19-25. DOI: 10.1007/s11934-012-0293-6
[8] Hofmann HS, Meef H, Krohe K, et al.Prognostic factors and survival after pulmonary resction of metastatic renal cell carcinoma[J].Eur Urol, 2005, 48:77-81. DOI: 10.1016/j.eururo.2005.03.004
[9] Coleman RE.Metastatic bone disease:clinical features, pathophysiology and treatment strategies[J].Cancer Treat Rev, 2001, 27:165-176. DOI: 10.1053/ctrv.2000.0210
[10] Fuchs B, Trousdale RT, Rock MG. Solitary bony metastasis from renal cell carcinoma:significance of surgical treatment[J]. Clin Orthop Relat Res, 2005, (431):187-192. DOI: 10.1097/01.blo.0000149820.65137.b4
[11] Pantuck AJ, Zisman A, Dorey F, et al.Renal cell carcinoma with retroperitoneal lymph nodes:role of lymphnode dissection[J].J Urol, 2003, 169:2076-2083. DOI: 10.1097/01.ju.0000066130.27119.1c
-
期刊类型引用(1)
1. 王雨生,双卫兵. 转移性肾癌患者行转移灶切除术的临床价值. 泌尿外科杂志(电子版). 2019(04): 9-12 .  百度学术
百度学术
其他类型引用(1)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS

 下载:
下载: