Local Injections of Cholesterol-conjugated let-7a Mimics Inhibit Tumor Growth and Metastasis of Hepatocellular Carcinoma in a Subcutaneous Xenograft Nude Mouse Model by Targeting K-Ras, H-Ras, and N-Ras
-
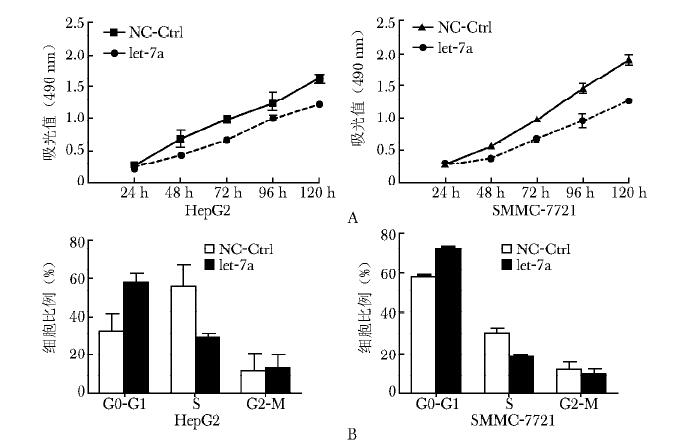
摘要:目的 研究胆固醇包裹let-7a模拟物(mimics)是否能通过下调人3种Ras抑制肝癌发展, 寻找肝癌的潜在治疗策略目的 采用MTT增殖分析、PI单染和Annexin V/FITC双染方法检测let-7a mimics在体外对肝癌细胞的作用。使用裸鼠皮下移植瘤模型和通过肿瘤局部注射方法观察let-7a mimics对体内肝癌的作用。采用实时定量PCR和Western blot方法检测let-7a及其靶点Ras的表达结果 与阴性对照组相比, let-7a mimics转染的肝癌细胞let-7a水平升高, 细胞增殖缓慢(P均 < 0.05);let-7a mimics阻滞更多肝癌细胞停留在G0-G1期且促进肝癌细胞凋亡(P均 < 0.05)。经let-7a mimics治疗的裸鼠体内肿瘤体积较阴性对照组减小, 是阴性对照组的54.97%(P=0.039);局部浸润和肝脏转移较阴性对照组明显减轻。肝癌细胞和移植瘤组织内let-7a上调的同时, 人K-Ras、H-Rras和N-Ras mRNA和蛋白的表达降低(P均 < 0.05)结论 let-7a mimics下调人3种Ras mRNA和蛋白的表达, 影响细胞周期, 进而抑制细胞增殖和促进细胞凋亡。瘤周多点注射胆固醇包裹的let-7a mimics能抑制移植瘤的生长、浸润和转移。提示let-7阻断Ras可成为肝癌治疗的研究策略。Abstract:Objective To investigate the potential antitumor effects of cholesterol-conjugated let-7a mimics (let-7a mimics) on hepatocellular carcinoma (HCC) by down-regulating all 3 human Ras, with the aim to explore alternative therapeutic strategy for HCC.Methods Effects of let-7a mimics on HCC cells in vitro were detected using MTT-based cell proliferation assays in combination with propidium iodide staining and annexin-V/FITC double staining. The antitumor effects in vivo of let-7a mimics on HCC growth were analyzed in subcutaneous xenograft nude mice with intra-tumoral injections. Expressions of let-7a and its target human Ras were examined with real-time PCR and Western blot.Results let-7a mimics-transfected HCC cells showed increased let-7a levels and slower proliferation compared with the negative controls (both P < 0.05). let-7a mimics induced more cell-cycle arrest at the G0-G1 phase and promoted apoptosis of HCC cells (both P < 0.05). In addition, significant reductions in tumor size, local invasion and metastasis to liver were observed in let-7a mimics-treated nude mice compared to negative controls. The tumor size after let-7a treatment was 54.97% that of negative controls (P=0.039). Furthermore, the up-regulation of let-7a coincided with the reduction of K-Ras, H-Rras, and N-Ras mRNA and protein expressions in HCC cells and xenograft tumor (all P < 0.05).Conclusions let-7a mimics could affect cell cycle, inhibit cell proliferation and promote cell apoptosis by downregulation of mRNA and protein expressions of all the 3 human Ras. Local injections of cholesterol-conjugated let-7a mimics could effectively suppress the growth, invasion and metastasis of xenograft tumor. These findings suggest that Ras-targeting let-7 mimics could be a potential therapeutic option for HCC.
-
Keywords:
- hepatocellular carcinoma /
- let-7a /
- K-Ras /
- H-Ras /
- N-Ras /
- cell cycle /
- local injection treatment
-
颈静脉球瘤(glomus jugulare tumor, GJT)是起源于颈静脉血管外膜的副神经节瘤,是颈静脉孔区常见的肿瘤之一。GJT发病率为0.003%(1/30 000),生长速度缓慢,绝大多数为良性病变。但瘤体中血管丰富,具有局部侵袭性生长的特点[1-3]。手术切除是GJT最主要的治疗方式,亦是可彻底清除病变的唯一方式[1],其中颞下窝入路(infratemporal fossaapproach,IFA)是较常用的术式[4]。在临床实践中,许多病变采用单一类型的IFA难以彻底暴露和切除,需采用多种手术入路,即颞下窝联合入路(combined infratemporal fossa approach, CIFA),以彻底切除肿瘤,并同时最大程度减少神经损伤[5]。MRI可有效评估肿瘤形态及其受累范围,有助于指导制订治疗策略及手术方式[3]。脑容积成像(brain volume imaging,BRAVO)序列是一种MRI三维容积采集序列,具有较高的空间分辨率,且不受血流造成的伪影的影响[6-7]。本研究探讨GJT患者术前MRI BRAVO增强影像特征与手术入路的关系,旨在为手术入路的制订提供更多影像信息。
1. 资料与方法
1.1 研究对象
回顾性收集并分析2015年2月至2021年3月北京协和医院行手术治疗的GJT患者临床资料。纳入标准:(1)GJT均经术后组织病理证实;(2)手术入路为IFA或CIFA;(3)术前均行颞骨MRI检查,并根据Fisch分型标准[8-10],判断肿瘤为C型或D型。排除标准:无增强BRAVO序列影像数据或图像质量不清晰者。根据患者病历资料中记录的手术入路,将患者分为IFA组、CIFA组。
本研究已通过北京协和医院伦理审查委员会审批(审批号:S-K1824-1)。
1.2 研究方法
1.2.1 MRI设备及参数
检查设备为3.0T磁共振扫描仪(Discovery MR 750 3.0T system,GE Healthcare, Milwaukee, WI)及8通道头颈联合线圈。以颞骨病灶为中心,进行侧颅底扫描。扫描序列包括轴位T1加权成像(TR= 1650 ms,TE=24 ms,视野=18 cm, 层厚=4 mm,层间距=0.6 mm,矩阵=320×224)、轴位T2加权成像(TR=6832 ms,TE=112 ms, 视野=18 cm,层厚=4 mm,层间距=0.6 mm, 矩阵=320×224)、轴位增强BRAVO序列成像(TR=7.3 ms,TE=2.7 ms,反转角=12,视野=22 cm,NEX=1,层厚=1~2 mm,矩阵=256×256)。增强扫描时,采用高压注射器经上臂静脉注射对比剂钆喷酸葡甲胺(Gd-DTPA),剂量为0.1 mmol/kg,注射速率为2.5 mL/s。
1.2.2 图像后处理
所有图像传输至PACS工作站,由两位具有高级职称的影像学医师共同完成增强BRAVO图像阅片,并根据Fisch分型标准[8-10],对肿瘤进行分型。(1)C型为肿瘤起源于颈静脉球穹窿部,根据颈动脉管受累程度进一步分级:①C1型:肿瘤局限于颈静脉孔,但未累及颈内动脉;②C2型:肿瘤侵及颈动脉管垂直段(颈动脉孔至颈内动脉转弯处之间);③ C3型:肿瘤沿着颈动脉水平段生长,但未达破裂孔;④C4型:肿瘤到达破裂孔,并沿颈内动脉侵及海绵窦(图 1)。(2)D型为肿瘤已侵犯颅内,浸润硬膜外(De)或硬膜内(Di),根据肿瘤向后颅窝浸润深度进一步分型:①De1型:后颅窝硬脑膜移位≤2 cm;②De2型:后颅窝硬脑膜移位>2 cm;③Di1型:肿瘤硬膜内浸润深度≤2 cm,未累及脑桥延髓部脑干;④Di2型: 肿瘤硬膜内浸润深度>2 cm,与脑桥延髓处的血管和神经相粘连;⑤Di3型:神经外科无法切除(图 2)。
通过术前增强BRAVO序列影像特征评估得到的Fisch分型,记为影像分型;根据手术记录及术后病理得到的Fisch分型,记为手术分型。在增强BRAVO序列轴位图像上测量横轴位肿瘤最大径,在重建的冠状位图像上测量冠状位肿瘤最长径。对于影像分型为D型的肿瘤,额外测量肿瘤侵犯脑膜的最宽径,记为脑膜侵犯宽度;推压脑膜或侵犯颅内最深径,记为脑膜侵犯深度。
1.3 质量控制
勾画感兴趣区域(region of interest, ROI)时严格遵守标准操作流程,以降低病灶选取不规范对分析结果造成的干扰。BRAVD影像分析由两名高级职称的影像学医师共同完成,并达成一致意见作为最终结果。
1.4 统计学处理
采用SPSS 23.0软件进行统计学分析。横轴位肿瘤最大径、冠状位肿瘤最长径、脑膜侵犯深度、脑膜侵犯宽度为计量资料,且满足正态性分布,以均数±标准差表示,组间比较采用独立样本t检验。性别、Fisch分型等计数资料以频数(百分数)表示,比较采用Wilcoxon秩和检验或Fisher精确概率法。采用Kappa检验评估影像Fisch分型与手术Fisch分型的一致性。以P<0.05为差异具有统计学意义。
2. 结果
2.1 一般临床资料
共25例符合纳入和排除标准的GJT患者入选本研究。其中男性4例(16.0%),女性21例(84.0%);平均年龄(44.5±12.4)岁(范围:24~62岁);病灶位于左侧14例,右侧11例;主要临床症状为搏动性耳鸣伴听力下降者5例,面瘫伴听力下降者2例,仅耳鸣7例,仅面瘫1例,面瘫伴耳鸣1例,耳鸣、面瘫及听力下降同时存在6例,无明显临床症状者3例。患者均无家族史。1例患者存在颈部淋巴结转移,考虑为恶性GJT。6例患者存在尿儿茶酚胺升高,考虑GJT具有神经内分泌功能。
IFA组16例,均为女性,平均年龄(44.1±12.8)岁。CIFA组9例,男性4例(44.4%),女性5例(55.6%);平均年龄(45.3±12.4)岁。两组患者性别比例有显著性差异(P=0.004),年龄无显著性差异(P=0.812)。
2.2 颈静脉球瘤影像分型与手术分型的一致性
25例患者,根据术前增强BRAVO影像特征确定的Fisch分型:C1型1例、C2型5例、C2De1型4例、C2Di1型1例、C3De1型4例、C3Di1型4例、C3Di2型4例、C4Di1型1例、C4Di2型1例。其中影像C分型:C1型1例、C2型10例、C3型12例、C4型2例。共19例患者存在脑膜受累,影像D分型:De1型8例、Di1型6例、Di2型5例。除IFA组1例患者术前影像为C3型,而术后评价为C2型外,其余患者影像C分型与手术C分型一致(Kappa=0.934,P<0.001)。19例患者影像D分型与手术D分型均一致(Kappa=1.000,P<0.001)。
2.3 颈静脉球瘤术前影像分型与手术方式的关系
IFA组患者手术入路均为Type A型(颞下窝A型入路),术前影像分型C1型1例(6.3%),C2型9例(56.3%),C3型6例(37.5%);62.5%(10/16)的患者存在脑膜侵犯,术前影像分型De1型7例(43.8%),Di1型2例(12.5%),Di2型1例(6.3%)。
CIFA组手术入路均为Type A型+Type B型(颞下窝A型+B型入路);术前影像分型C2型1例(11.1%),C3型6例(66.7%),C4型2例(22.2%);患者均有脑膜侵犯(100%,9/9),术前影像分型De1型1例(11.1%),Di1型4例(44.4%),Di2型4例(44.4%)。两组术前影像C分型(P=0.029)、D分型(P=0.006)均有显著差异。
2.4 两组患者术前影像特征比较
CIFA组横轴位肿瘤最大径(P=0.013)、脑膜侵犯深度(P=0.003)、脑膜侵犯宽度(P=0.011)均大于IFA组,冠状位肿瘤最长径(P=0.125)与IFA组无显著性差异,见表 1。
表 1 不同手术入路患者的术前增强脑容积成像序列影像特征比较(x±s, mm)组别 横轴位肿瘤最大径 冠状位肿瘤最长径 脑膜侵犯深度* 脑膜侵犯宽度* IFA组(n=16) 23.54±9.09 25.94±13.44 5.42±2.71 15.80±5.39 CIFA组(n=9) 35.02±12.03 37.19±22.13 10.70±3.92 26.67±10.56 P值 0.013 0.125 0.003 0.011 IFA:颞下窝入路;CIFA:颞下窝联合入路;*仅适用于术前影像Fisch分型D型患者 3. 讨论
本研究首次采用增强BRAVO序列显示GJT患者术前MRI影像Fisch分型,并分析术前影像特征与患者手术入路的关系,结果表明不同手术入路患者间术前影像分型、横轴位肿瘤最大径、脑膜侵犯深度及脑膜侵犯宽度存在统计学差异。
GJT多见于女性患者,男女比例约为1∶(2~5),好发年龄40~60岁,20%有家族史。绝大部分GJT为良性病变,致死率为5%~13%,恶变率为1%~12%;约1%~3% 具有神经分泌功能[11-12]。本研究病例中,84%为女性,平均年龄44.5岁,均无家族史,1例(4%)存在恶变,与文献报道基本相符。本研究6例(24%)患者的尿儿茶酚胺升高,考虑存在神经内分泌功能,高于文献报道,其原因有待进一步探究。
IFA外科技术由Fisch教授在20世纪70年代发明,手术入路包括Type A、Type B、Type C、Type D 4种分型,其中A型主要用于颈静脉孔区肿瘤的暴露及切除,B型主要用于斜坡、岩尖、颈动脉水平段部位肿瘤的切除,C型主要用于脑桥腹侧、海绵窦及咽鼓管部位病变的切除,D型主要用于切除颞下窝、眶尖等部位的病变[5]。GJT多采用Type A型入路,通过充分磨除颞骨骨质(岩骨次全切除)、面神经前移暴露颞骨迷路下、岩尖、下颌窝和颞下窝后部,最大程度暴露病变范围,以彻底切除病变,是切除C型及D型GJT的理想路径[1]。但由于GJT多数病变范围广泛,累及周围组织或更远的部位。因此,对于GJT患者,有时单纯某一种入路难以完全切除肿瘤,需根据病变范围选择联合入路[5]。本研究IFA组均采用Type A型入路,CIFA组均采用Type A型+Type B型入路。CIFA组患者横轴位肿瘤最大径大于IFA组患者,冠状位肿瘤最长径与IFA组患者无显著性差异,提示肿瘤横轴位方向生长情况对手术入路的影响较大。
术前通过影像学资料对肿瘤范围准确评估有助于病变的完整切除。常用术前影像评估方法包括高分辨CT与MRI,必要时需结合数字减影血管造影检查评估肿瘤的供血情况。颞骨高分辨CT主要用于评估病变范围及骨质破坏情况。MRI具有较高的软组织分辨率,在评估肿瘤侵犯范围、与血管的关系、脑膜受累程度方面均优于高分辨率CT,可为肿瘤临床分型提供可靠依据[3]。临床常规使用的T1/T2加权成像,通常采用快速自旋回波序列,易受颅底静脉血流伪影的影响,导致对病变范围的评价不准确。此外,常规增强T1加权成像为二维图像,仅可在二维层面对病变进行评价。本研究采用的BRAVO序列是一种并行成像技术,可在较短时间内完成MRI脑颅三维容积快速扫描,并进行任意平面重建[7, 13]。本研究增强BRAVO序列扫描时间仅为1分34秒,扫描速度较快;除评价肿瘤在轴位图像上的表现外,还可通过重建冠状位图像,评估肿瘤在冠状位上的生长情况。此外,由于BRAVO序列具有更短的回波时间,可减少脑内血流的流动伪影[7],有利于显示肿瘤对脑膜的侵犯情况。本研究19例患者术前BRAVO序列影像特征提示存在脑膜侵犯,其中11例存在硬膜内侵犯,均经手术得到证实,提示BRAVO序列对GJT侵犯脑膜的评估具有较高的准确性。
本研究基于术前增强BRAVO序列影像特征,对GJT进行Fisch分型,得到影像C分型及影像D分型,结果显示除IFA组1例患者术前影像分型为C3型,经手术证实为C2型外,其余患者影像C、D分型与手术C、D分型均一致,提示根据术前BRAVO序列影像表现可基本实现对GJT进行准确分型,进而为手术入路的选择提供参考意见。本病例中,IFA组与CIFA组术前影像C分型、D分型均有显著差异。所有影像分型C1型的病例均行IFA手术,所有影像分型为C4型的病例均行CIFA手术。1例影像分型为C2型的病例,伴较严重的脑膜侵犯(影像D分型为Di1),行CIFA手术,其余影像分型C2型病例均行IFA手术。对于影像分型C3型病例,IFA与CIFA手术各占50%,提示对于影像分型C3型病例,手术方式的选择,尚需结合更多因素。对于影像D分型病例,所有Di2分型均行CIFA手术,大部分Di1分型(66.7%,4/6)行CIFA手术,大部分De1分型(87.5%,7/8)行IFA手术。因此,术前增强BRAVO序列影像特征可为GJT患者手术入路的选择提供参考。
此外,本研究对影像D分型病变患者的脑膜受累进行定量评估,结果表明CIFA组患者的脑膜侵犯深度和宽度更明显,亦提示术前增强BRAVO序列影像参数特征与手术入路具有一定关系。
本研究局限性:(1)样本量较小,且缺乏Fisch分型De2型的病例,未来需扩大样本量,进一步验证本研究结果。(2)患者性别分布在不同手术入路分组之间存在差异,可能为混杂因素。本研究未按性别进行分层分析。(3)仅纳入了增强BRAVO序列影像特征,后续可考虑结合多个序列的影像特征,进一步分析术前影像特征与手术入路的相关性。(4)未建立验证队列,未对影像指标进行诊断效能评估。
综上,增强BRAVO序列影像特征可用于术前评估GJT患者的Fisch分型, 术前BRAVO序列的影像特征在不同手术入路患者间存在差异。
-
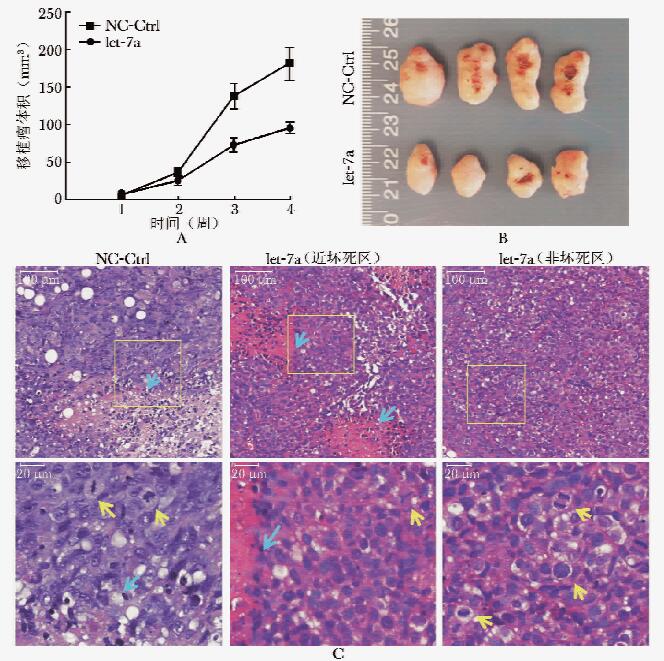
图 2 let-7a mimics对裸鼠皮下肝癌移植瘤的影响
A.裸鼠皮下移植瘤生长曲线;B.局部注射给药4周,移植瘤实验结束后移植瘤大小及其侵及皮肤溃疡情况;C.移植瘤组织病理学,蓝色箭头示坏死区,黄色箭头示细胞分裂象(HE染色)
let-7a、NC-Ctrl:同图 1图 3 let-7a mimics体内注射对裸鼠皮下肝癌移植瘤组织内let-7a和人3种Ras的作用
A.实时定量PCR检测体内移植瘤组织内let-7a水平;B.实时定量PCR检测裸鼠皮下移植瘤组织内人3种Ras mRNA的水平; C.Western blot检测移植瘤组织内人3种Ras蛋白水平
let-7a、NC-Ctrl:同图 1 -
[1] Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma[J]. Hepatology, 2008, 48:2047-2063. DOI: 10.1002/hep.22580
[2] Wei KR, Yu X, Zheng RS, et al. Incidence and mortality of liver cancer in China, 2010[J].Chin J Cancer, 2014, 33:388-394. http://pubmedcentralcanada.ca/pmcc/articles/PMC4135368/
[3] Lai EC. MicroRNAs are complementary to 3'UTR sequence motifs that mediate negative post-transcriptional regulation[J]. Nat Genet, 2002, 30:363-364. DOI: 10.1038/ng865
[4] Calin GA, Sevignani C, Dumitru CD. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad, 2004, 101:2999-3004. DOI: 10.1073/pnas.0307323101
[5] Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6:857-866. DOI: 10.1038/nrc1997
[6] Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75:843-854. DOI: 10.1016/0092-8674(93)90529-Y
[7] Reinhart BJ, Slack FJ, Basson M. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans[J]. Nature, 2000, 403:901-906. DOI: 10.1038/35002607
[8] Roush S, Slack FJ. The let-7 family of microRNAs[J]. Trends Cell Biol, 2008, 18:505-516. DOI: 10.1016/j.tcb.2008.07.007
[9] Kumar MS, Erkeland SJ, Pester RE, et al. Suppression of non-small cell lung tumor development by the let-7 microRNA family[J]. Proc Natl Acad Sci USA, 2008, 105:3903-3908. DOI: 10.1073/pnas.0712321105
[10] He XY, Chen JX, Zhang Z, et al. The let-7a microRNA protects from growth of lung carcinoma by suppression of K-Ras and c-Myc in nude mice[J]. J Cancer Res Clin Oncol, 2010, 136:1023-1028. DOI: 10.1007/s00432-009-0747-5
[11] Torrisani J, Bournet B, du Rieu MC, et al. let-7 MicroRNA transfer in pancreatic cancer-derived cells inhibits in vitro cell proliferation but fails to alter tumor progression[J]. Hum Gene Ther, 2009, 20:831-844. DOI: 10.1089/hum.2008.134
[12] Appari M, Babu KR, Kaczorowski A, et al. Sulforaphane, quercetin and catechins complement each other in elimination of advanced pancreatic cancer by miR-let-7 induction and K-Ras inhibition[J]. Int J Oncol, 2014, 45:1391-1400. DOI: 10.3892/ijo.2014.2539
[13] Jin H, Lv S, Yang J, et al. Use of microRNA let-7 to control the replication specificity of oncolytic adenovirus in hepatocellular carcinoma cells[J]. PLoS One, 2011, 6:e21307. DOI: 10.1371/journal.pone.0021307
[14] Johnson CD, Esquela-Kerscher A, Stefani G, et al. The let-7 microRNA represses cell proliferation pathways in human cells[J]. Cancer Res, 2007, 67:7713-7722. DOI: 10.1158/0008-5472.CAN-07-1083
[15] Johnson SM, Grosshans H, Shingara J, et al. RAS is regulated by the let-7 microRNA family[J]. Cell, 2005, 120:635-647. DOI: 10.1016/j.cell.2005.01.014
[16] Tsang WP, Kwok TT. let-7a microRNA suppresses therapeutics-induced cancer cell death by targeting caspase-3[J]. Apoptosis, 2008, 13:1215-1222. DOI: 10.1007/s10495-008-0256-z
[17] Chen KJ, Hou Y, Wang K, et al. Reexpression of let-7g microRNA inhibits the proliferation and migration via K-Ras/HMGA2/snail axis in hepatocellular carcinoma[J]. Biomed Res Int, 2014, 2014:742417. DOI: 10.1155/2014/742417
[18] Calvisi DF, Ladu S, Gorden A, et al. Ubiquitous activation of Ras and Jak/Stat pathways in human HCC[J]. Gastroenterology, 2006, 130:1117-1128. DOI: 10.1053/j.gastro.2006.01.006
[19] Calvisi DF, Ladu S, Conner EA, et al. Inactivation of Ras GTPase-activating proteins promotes unrestrained activity of wild-type Ras in human liver cancer[J]. J Hepatol, 2011, 54:311-319. DOI: 10.1016/j.jhep.2010.06.036
[20] Zhu XM, Wu LJ, Xu J, et al. let-7c microRNA expression and clinical significance in hepatocellular carcinoma[J]. J Int Med Res, 2011, 39:2323-2329. DOI: 10.1177/147323001103900631
[21] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-DeltaDeltaC (T)) Method[J]. Methods, 2001, 25:402-408. DOI: 10.1006/meth.2001.1262
[22] Shields JM, Pruitt K, McFall A. Understanding Ras:'it ain't over til it's over'[J]. Trends Cell Biol, 2000, 10:147-154. DOI: 10.1016/S0962-8924(00)01740-2
[23] Marshall C. How do small GTPase signal transduction pathways regulate cell cycle entry?[J]. Curr Opin Cell Biol, 1999, 11:732-736. DOI: 10.1016/S0955-0674(99)00044-7
[24] Downward J. Cancer biology:signatures guide drug choice[J]. Nature, 2006, 439:274-275. DOI: 10.1038/439274a
[25] Schubbert S, Shannon K, Bollag G. Hyperactive Ras in developmental disorders and cancer[J]. Nat Rev Cancer, 2007, 7:295-308. DOI: 10.1038/nrc2109
[26] Bussing I, Slack FJ, Grosshans H. let-7 microRNAs indeve-lopment, stem cells and cancer[J]. Trends Mol Med, 2008, 14:400-409. DOI: 10.1016/j.molmed.2008.07.001
[27] Boyerinas B, Park SM, Hau A, et al. The role of let-7 in cell differentiation and cancer[J]. Endocr Relat Cancer, 2010, 17:F19-F36. DOI: 10.1677/ERC-09-0184
[28] Roush S, Slack FJ. The let-7 family of microRNAs[J].Trends Cell Biol, 2008, 18:505-516. DOI: 10.1016/j.tcb.2008.07.007
[29] Callegari E, Elamin BK, Sabbioni S, et al. Role of micro-RNAs in hepatocellular carcinoma:a clinical perspective[J]. Onco Targets Ther, 2013, 6:1167-1178. http://www.dovepress.com/role-of-micrornas-in-hepatocellular-carcinoma-a-clinical-perspective-peer-reviewed-article-OTT
[30] Hou J, Lin L, Zhou W, et al. Identification of miRNomes in human liver and hepatocellular carcinoma reveals miR-199a/b-3p as therapeutic target for hepatocellular carcinoma[J]. Cancer Cell, 2011, 19:232-243. DOI: 10.1016/j.ccr.2011.01.001
[31] Giordano S, Columbano A. MicroRNAs:new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma?[J]. Hepatology, 2013, 57:840-847. DOI: 10.1002/hep.26095
[32] Liu YM, Xia Y, Dai W, et al. Cholesterol-conjugated let-7a mimics:antitumor efficacy on hepatocellular carcinoma in vitro and in a preclinical orthotopic xenograft model of systemic therapy[J]. BMC Cancer, 2014, 14:889. DOI: 10.1186/1471-2407-14-889
-
期刊类型引用(1)
1. 毛铭阳,苏童,冯国栋,田旭,徐振潭,陈钰,张竹花,高志强,金征宇. 磁共振脑容积成像对颈静脉球瘤脑膜侵犯的诊断价值. 临床放射学杂志. 2022(04): 612-617 .  百度学术
百度学术
其他类型引用(0)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 邮件订阅
邮件订阅 RSS
RSS


 下载:
下载: