

·指南与共识·
戈谢病(Gaucher disease,GD)是一种常染色体隐性遗传代谢障碍性疾病,由于葡萄糖脑苷脂酶(glucocerebrosidase,GBA)基因突变导致机体溶酶体中GBA活性降低,造成其底物葡萄糖脑苷脂(亦称葡糖神经酰胺)在肝、脾、骨骼、肺、脑及眼部等器官的巨噬细胞溶酶体中贮积,形成“戈谢细胞”,常表现为肝脾肿大、骨痛、贫血、血小板减少、神经系统症状,也可出现其他系统受累表现,并可能在病程中进行性加重。根据是否累及神经系统及疾病进展速度,GD分为3种类型:(1)Ⅰ型,非神经病变型,最常见,无原发性中枢神经系统受累表现;(2)Ⅱ型,急性神经病变型,伴有广泛且严重的内脏受累,一般于出生后一年内发病,患儿大多于2岁前死亡;(3)Ⅲ型,慢性神经病变型,其发病率较Ⅱ型高,常于儿童期发病,病情进展相对缓慢[1-2]。
由于患者表现为多系统受累,全面的评估和诊治需多学科团队协作。为促进GD诊疗的规范化,北京协和医院特别成立编写组,邀请本病可能累及的各系统相关临床专家及参与诊断的平台科室专家,结合GD的临床表现及诊治进展,制定多学科诊疗专家共识如下。
肝脾肿大是GD消化系统受累的主要表现,尤以脾肿大显著,常伴脾功能亢进,有时会出现巨脾、脾梗死、脾破裂等[3]。肝脾肿大可能隐匿无症状,或表现为早饱、腹胀、腹部不适或上腹隐痛,极少可因发生脾梗死而表现为急性腹痛。患者通常伴有肝纤维化,肝功能衰竭、肝硬化和门静脉高压不常见,但脾切除患者除外[4]。肝脾肿大多归因于炎症性和增生性细胞反应,病理性脂质蓄积所占比率<2%。
1.2.1 实验室检查:检测凝血功能、肝功能等评估肝脏受累情况,酌情完善嗜肝病毒、血清铜、铜蓝蛋白、铁蛋白、转铁蛋白饱和度、总铁结合力等指标的检测,以协助鉴别诊断。
1.2.2 影像学:腹部超声具有简便易行的优点,并可初步筛查有无占位性病变及初步评价肝脾硬度。可进一步酌情选择CT、MRI、瞬时弹性成像等精确影像评估手段。
1.2.3 肝脏穿刺:对于不明原因肝脾肿大和肝酶升高的患者,肝脏穿刺活检发现戈谢细胞有助于GD的诊断。但由于血小板减少和凝血功能障碍,肝脏穿刺出血风险较高,应谨慎选择。
1.2.4 鉴别诊断: GD患者多以脾肿大、伴或不伴肝脏肿大为首发或主要表现,同时多伴有血小板减少、贫血等异常。当缺乏神经系统、骨骼或肺等相关表现,而血小板减少和贫血又被单纯考虑为脾功能亢进所致时,易导致GD的漏诊或误诊,故应与其他病因导致的脾肿大进行鉴别[1,3]。
酶替代疗法(enzyme replacement therapy, ERT)可显著改善肝脾肿大症状,建议治疗过程中规律监测肝脾体积及硬度变化,以评价治疗效果。治疗目标:1~2年内分别使脾脏和肝脏体积减小到正常值的2~8倍和1~1.5倍以内(具体减小幅度的判断应取决于基线水平),并长期维持此水平,同时阻止肝纤维化进展,防止严重的肝硬化及门静脉高压的发生。若患者无法接受ERT,或ERT后仍存在病情进展(如脾功能亢进、脾梗死等)难以控制等情况时,可谨慎考虑脾切除[4]。
1.4.1 肝纤维化、肝硬化及门静脉高压:随着病程进展,肝脏会发生不同程度的纤维化,少数患者甚至进展为肝硬化及门静脉高压,其机制尚未阐明。影像学和组织病理学分析发现,肝纤维化程度与GD严重程度有关,脾切除可能亦会增加肝纤维化的严重程度[4]。
1.4.2 肝癌:GD与恶性肿瘤发生风险增加有关,包括血液恶性肿瘤和实体器官肿瘤如肝癌等,目前具体机制未明[5]。另外,持续的高铁蛋白血症及肝脏铁过载亦是肝癌发生的潜在危险因素。因此,建议对GD患者定期复查甲胎蛋白及肝脏影像学。
1.4.3 胆石症:GD患者中胆石症的发病率较一般人群明显升高,且以胆固醇性胆结石为主,目前认为该现象可能与GD脂质代谢障碍有关。
2.1.1 血细胞减少:贫血、血小板/白细胞减少、粒细胞缺乏可单独或同时出现,患者就诊时淋巴细胞减少比中性粒细胞减少更常见。血小板减少在未行脾切除术的患者中更常见,其发生早于贫血和白细胞减少[4]。GD患者贫血症状较隐匿且不特异,血小板减少可能导致出血和易发瘀斑。发生的原因为骨髓戈谢细胞浸润及脾功能亢进,而骨髓纤维化和骨质硬化也可导致局部造血功能下降[3]。此外,在GD体外研究中发现,原始造血细胞和间充质祖细胞增殖受损,亦存在间充质干细胞分化为成骨细胞的能力受损,这表明血细胞减少的原因可能存在固有缺陷。GD患者贫血和血小板减少程度与是否接受过脾切除术治疗有关。
2.1.2 出血倾向:Ⅰ型GD患者出血倾向增加与血小板减少、凝血功能异常及血小板功能缺陷相关。报道显示,一些GD患者伴有获得性血管性血友病[2]。
2.1.3 脾肿大:富含脂质的巨噬细胞在脾脏蓄积,可导致脾肿大。戈谢细胞具有所谓的替代激活巨噬细胞的蛋白表达谱,这是一种与慢性炎症及纤维化相关的表型。脾肿大可继发脾功能亢进。
2.1.4 恶性肿瘤风险增加:常见单/多克隆免疫丙种球蛋白病、浆细胞疾病的发病率增加。血细胞计数异常且伴有M蛋白增加时应谨慎解读,根据临床表现、M蛋白定量可区分是GD导致还是同时存在克隆性浆细胞疾病。GD患者的恶性肿瘤发病率亦较普通人群增高,尤其是血液系统恶性肿瘤(淋巴瘤、白血病和多发性骨髓瘤),一些患者甚至可出现多种恶性肿瘤[5],推测修饰基因的突变可能是导致此类患者癌症易感性增加的基础。
骨髓中可发现戈谢细胞,胞体大或巨大,核小,有时可见核畸形、双核及多核,染色质致密;胞浆量丰富,呈灰蓝色“洋葱皮”样排列(图1)。戈谢细胞酸性磷酸酶活性升高,必要时可进行酸性磷酸酶染色。戈谢细胞亦可见于一些血液系统疾病及感染性疾病,此时称为“类戈谢细胞”,在慢性粒细胞白血病、地中海贫血、骨髓增生异常综合征、多发性骨髓瘤、华氏巨球蛋白血症、霍奇金淋巴瘤、其他淋巴瘤伴单克隆免疫球蛋白血症甚至非典型分枝杆菌感染中均可能出现这种“类戈谢细胞”[1]。因此,当骨髓中存在戈谢细胞时,虽应高度怀疑GD,但需进一步行GBA活性测定以确诊。
早期诊断及采用ERT,可有效改善GD患者血细胞减少、出血倾向、脾肿大症状,从而进一步改善患者生活质量,预防不可逆并发症的出现[5]。对于病程较长,有多发脾梗死、治疗后脾回缩不良时,ERT后患者的贫血和血小板减少提升有限。
需注意,脾切除虽能有效改善血细胞减少和脾肿大症状,但现有共识推荐,除非存在危及生命的出血事件或在特殊情况下,由经验丰富的医师评估后才可考虑脾切除,否则在可进行ERT的情况下GD患者应尽量避免脾切除,因脾切除术后会加速葡萄糖脑苷脂在骨髓、肝脏、肺脏等器官的蓄积,导致临床症状加剧,并增加多种GD并发症(如骨病及骨危象、肺动脉高压、肝病等)及感染、胆石症的发生风险[4]。另外,对任何考虑脾切除的不明原因脾肿大患者,建议首先完善酶活性检测。
既往临床观察中,异基因造血干细胞移植(hematopoietic stem cell transplantation,HSCT)对非神经型GD有确切疗效,是潜在可能治愈GD的疗法[6]。脾切除联合HSCT也被用于神经型GD治疗。对于部分难治性神经型GD患者,目前已有报道采用ERT序贯HSCT法治疗神经型GD,但HSCT并发症和病死率较高,目前仍缺乏对比HSCT和ERT的充分临床证据。欧美权威机构建议 HSCT 用于部分特定人群,且需慎重评估风险与获益。
GD可累及全身骨骼,轻重程度不一,其病理改变为戈谢细胞在骨骼内沉积,破坏并取代正常的骨组织。受侵犯部位主要包括早期的腰椎、长骨干骺端、骨干以及中后期的骨骺。约1/3的患者存在多个部位不同程度骨坏死,最常见于股骨头。骨坏死患者常有急/慢性骨痛,可出现突然发生的局部疼痛、红肿或发热,甚至发展为无菌性骨髓炎[7]。GD患者突然发作的骨骼病变亦称为“骨危象(bonecrisis)”,患者可出现白细胞升高,红细胞沉降率增快等表现。此外,在脊柱系统中,个别患者表现为后凸及侧凸畸形,以及由此引起的腰背部疼痛和/或下肢功能异常。当骨骼病变累及不同部位时,查体可发现不同的阳性体征,如累及股骨头者可出现髋关节活动受限及“4”字试验阳性;存在骨折者可出现剧痛、异常畸形及活动受限等体征;存在椎体骨折者可出现病变部位叩痛、脊柱后凸,严重者可有神经受压表现。
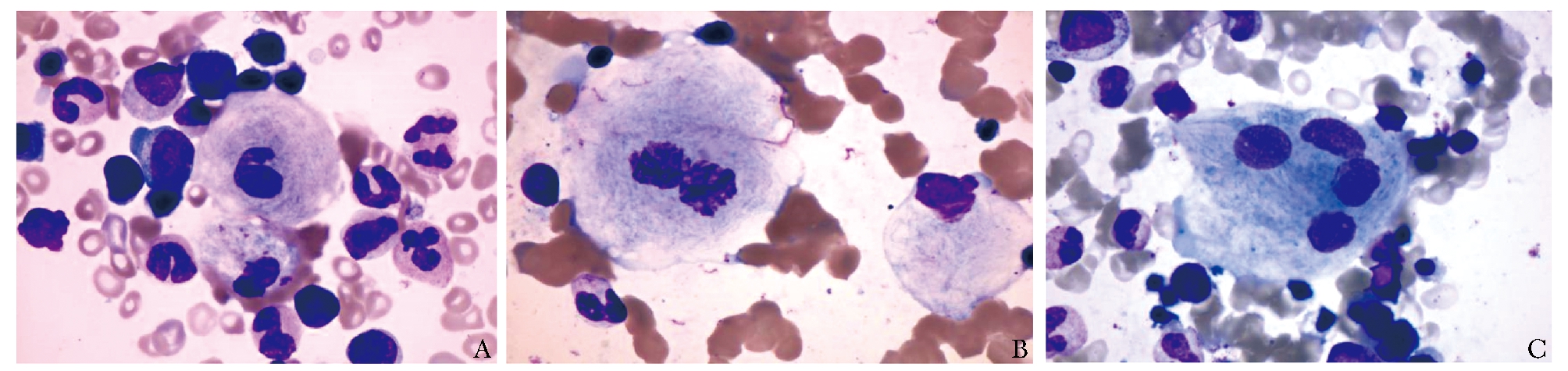
图 1 骨髓戈谢细胞特征
A.巨大细胞伴核畸形;B.双核戈谢细胞;C.多核戈谢细胞
骨骼病变可影响正常活动,并可致残。患儿常见的表现依次是骨质疏松、长骨干骺端“锥形瓶样”畸形、长骨干骺端密度不同程度减低、骨皮质变薄等,可有生长发育迟缓[8-9]。对于存在或疑似脊柱畸形的患者,站立位脊柱全长正侧位X线片及侧方弯曲相等均有助于明确诊断及指导下一步治疗。此外,全脊柱CT及MRI对评估脊柱畸形患者脊髓、神经根病变均具有较高的诊断价值。
3.3.1 一般治疗:对症处理如予以止痛药、理疗,伴有骨量减少或骨质疏松者可辅以钙剂、维生素D及双膦酸盐等抗骨质疏松治疗。
3.3.2 手术治疗:对于骨骼发育未成熟的患者,目前应用较广泛的手术方式包括一期后路半椎体切除短节段融合术、截骨短节段融合联合双生长棒技术等。如骨骼发育已成熟,可采用脊柱矫形融合术或截骨联合脊柱矫形融合术等:(1)四肢长骨骨折行钢板螺钉内固定;(2)骨折伴有股骨头坏死及关节损伤者,可考虑行人工关节置换术;(3)存在椎体骨折甚至脊髓神经压迫症状者,可行骨水泥及脊柱内固定治疗;(4)对于少数单纯脊柱侧凸或后凸患者,可根据具体情况选择不同手术方式。
3.3.3 康复治疗:一般骨折内固定术及关节置换术后,患者应早期进行肌肉、关节的功能锻炼,避免关节僵硬,防治骨质疏松。接受脊柱矫形手术的患者,应遵医嘱下床活动,术后6个月左右可进行慢跑、游泳等运动,有助于恢复脊柱关节活动度,保持正常的生理曲度[10]。
GD内分泌受累主要涉及生长发育、骨代谢、超重和糖代谢异常等。
4.1.1 生长发育障碍
30%~80%儿童/青少年起病的GD患者出现生长发育障碍,且与原发病病情密切相关[11]。表现为与同种族、性别、年龄正常儿童/青少年相比,生长速度减慢,身高低于遗传靶身高甚至正常人群身高-2SD。起病越早,身高受损越明显,血胰岛素样生长因子1(insulin-like growth factor-1, IGF-1)和胰岛素样生长因子结合蛋白3(IGF-binding protein-3,IGFBP-3)的水平显著降低[12]。2/3的GD患者存在青春期发育延迟,但对成年后的生育功能无显著影响。规范的ERT治疗后,患者的IGF-1水平显著升高,同时可观察到显著的追赶生长,线性生长速度显著改善。
儿童/青少年GD患者临床监测指标包括身高、体质量、第二性征发育情况、生长速度,对于有显著生长速度减慢和身高受损的患者,应进一步评价与生长发育相关的激素如IGF-1、IGFBP-3、甲状腺激素、性腺轴激素水平以及骨龄。
4.1.2 骨代谢相关
GD患者骨骼系统受累常见,导致局灶性骨溶解和骨质疏松相关临床表现。骨骼系统受累可影响儿童/青少年患者的生长,同时也会显著增加患者骨折及骨骼畸形风险,严重影响患者生活质量[7,13]。
80%的儿童/青少年患者在青春期发育前出现股骨远端、胫骨近端“锥形瓶样”骨骼畸形[14]。GD患者还可出现局灶性骨溶解,影像学可见骨皮质变薄和“锯齿样”骨内膜等“虫蚀样”改变。患者股骨头、肱骨上端和椎体可出现骨梗死,从而继发骨骼塌陷和病理性骨折。
儿童/青少年和成人GD患者均普遍存在骨密度减低[15],包括腰椎、股骨颈、大转子和桡骨远端,非暴力骨折风险增加5倍以上。建议当骨密度Z值<-1 时启动治疗以提高骨密度。因目前尚无明确规范,建议由骨代谢专科医师动态客观评价GD患者的骨密度、骨质量、钙磷代谢、骨形成/吸收的相关生化指标,评估骨折风险并给予相应治疗。
4.1.3 营养和糖代谢异常
24.2%的GD患者伴有纳差,营养不良发生风险较高,治疗前儿童/青少年GD患者中低体质量状态的发生率为5%~67%[11]。而成人GD患者或ERT治疗后患者超重和肥胖症的风险显著增加。目前研究发现,病情较重的GD患者即使体质量正常,也更易发生胰岛素敏感性下降及2型糖尿病[16]。GD患者随访过程中如发现体质量快速增长,需进行饮食营养评估和科学饮食,同时监测血糖,早期发现糖代谢异常。
无论成人还是儿童/青少年患者均应监测体质量指数,以客观评价患者的体质量及营养状态。监测空腹和餐后2 h血糖、空腹胰岛素、糖化血红蛋白等,必要时可行口服葡萄糖耐量试验以明确糖耐量状态。
ERT对骨骼的作用较血液系统和肝脏等明显延迟,且骨坏死、骨折等骨骼改变不可逆,虽然及时的ERT仍是GD患者维持骨骼健康、改善骨密度的重要治疗方法,但尚缺乏其能显著降低骨折风险的证据。维生素D、钙剂和双膦酸盐类药物对GD患者的骨密度等具有潜在获益,但尚无明确的治疗规范[3]。早期诊断并重视激素、营养代谢异常的综合评估,及时给予ERT及相应治疗有助于改善生长发育迟缓及代谢异常。
5.1.1 Ⅱ型及Ⅲ型GD伴有神经系统受累,属于神经病变型[17]。
5.1.1.1 Ⅱ型:并不常见,起病较早,通常于婴儿期发病。最初典型的神经系统表现为眼球运动障碍和球部麻痹,之后出现进行性加重的肌张力增高、强直、角弓反张、吞咽障碍、呼吸困难及癫痫发作,可伴有精神运动迟滞、听力障碍,预后差,多于2~4岁前死亡。Ⅱ型中一种罕见的、围产期致死性类型,亦是GD中最严重的亚型,临床表现为鳞癣状或“火棉胶样”皮肤病变、非免疫性胎儿水肿,多于宫内或新生儿期死亡。
5.1.1.2 Ⅲ型:患病率高于Ⅱ型,约占GD患者的7%。多于青少年期起病,部分患儿也可在2岁之前发病。早期表现与 Ⅰ 型相似,逐渐出现神经系统表现,病情进展缓慢,寿命可较长。临床特征多变,可进一步分为3个亚型(各亚型之间存在重叠)。(1)Ⅲa型:神经系统症状较早出现,表现为癫痫发作、肌阵挛、痴呆、共济失调、眼球运动障碍(斜视及核上性凝视麻痹),伴轻度肝脾肿大。(2)Ⅲb型: 神经系统受累较轻,核上性凝视麻痹可为唯一表现,也可伴有缓慢进展的小脑性语言障碍、肌阵挛或智力下降。源自瑞典北部Norrbottnian变异型即属于本亚型,此变异型与纯合L444P突变 (c.1448T>C等位基因)有关[18]。(3)Ⅲc型: 亦称心血管型。神经系统受累较晚,进展程度不一,表现为核上性凝视麻痹,常见于地中海盆地,与D409H突变(c.1342G>C等位基因)纯合子相关。
少数报道显示,Ⅰ型也可有不同于Ⅱ型和Ⅲ型的神经系统受累表现,如轻微周围神经病及帕金森病(Parkinson’s disease,PD),提示GD是一种谱系疾病[19]。另外,一些GD患者可能出现继发性神经系统受损,例如,因严重骨病导致脊髓或神经根受压,或因血液异常导致颅内出血等,应注意鉴别。
5.1.2 GBA突变与PD
GBA双等位基因致病变异可致常染色体隐性遗传的GD。携带1或2个GBA等位基因突变也是PD较为常见的遗传风险因素之一,但通常表现为不完全外显,即仅有部分携带者有临床表现[19]。神经系统疾病中,同一基因变异可导致多种不同表型,这种现象越来越常见,例如GBA基因变异可导致GD、PD等几种疾病。为给患者及其家庭成员提供更恰当的遗传咨询,临床工作者应了解并熟知这一概念。GD患者发展为PD的准确风险仍然未知,但与一般群体相比,其相对风险大概为20~30倍。约5%~10%的PD患者可检测到GBA致病基因突变,这些患者从临床表型、治疗策略来说,与其他不携带GBA突变的PD患者无显著差异。但携带GBA致病突变的PD患者发病年龄更早(约早5年),认知功能受损更常见,60岁和80岁时患PD的风险分别约为4.7% 和9.1%;GD患者的父母或子女(致病基因突变的肯定携带者)60岁和80岁时患PD的风险分别约为1.5%和 7.7%,非致病基因突变的携带者60岁和80岁时患PD的风险分别约为0.7%和 2.1%。
对于确诊GD的患者,即使无特殊神经系统症状,亦应尽早进行全面评估,明确是否存在神经系统受累及其程度,以助于判断预后及选择治疗方案。检查包括:神经系统查体、眼球运动检查、神经眼科学检查、听力测定、头部MRI、脑电图、脑干诱发电位及神经认知评估等。
目前尚无针对GD神经系统病变有效的特异性治疗手段。尚无证据显示HSCT、ERT或底物减少疗法(substrate reduction therapy, SRT)对Ⅱ型GD有效[20]。Ⅲ型GD患者可考虑ERT,部分患者可改善生活质量。对于无法接受ERT的Ⅲ型患者,可考虑SRT或HSCT。少数研究显示,分子伴侣疗法(氨溴索)对部分Ⅲ型GD患者的肌阵挛、癫痫发作控制有效,也可考虑对症治疗,如肌阵挛或癫痫发作患者可使用抗癫痫药。多巴胺治疗对PD可能有效,而ERT和SRT则对PD无效。另外,对于伴有精神心理障碍患者可考虑专科干预。
GD患者因脑干神经病变,可出现听觉神经通路损伤,罕有中耳乳突受累引起的传导性听力减退表现。
听觉脑干诱发电位(auditory brainstem evoked responses,ABR)是较理想的检测早期脑干病变的客观检查方法。通过给予声刺激,在头皮上记录由耳蜗到脑干听觉神经通路各级结构对声刺激产生的电反应。采用电生理技术与电子计算机平均叠加技术结合,使单次微小的诱发电位经过叠加显示出来[21]。在声刺激开始后的10 ms内,ABR正常时可出现7个波,分别用罗马数字Ⅰ~Ⅶ表示。临床上通过测量各波的振幅和潜伏期,判断有无听觉通路病变及病变位置。
ABR有助于早期检出脑干亚临床病灶,是检测脑干病变的听力测试中最灵敏、最特异的方法[22]。ABR检查廉价且无创,可在睡眠状态下进行,不受患者智力和行为限制,检查结果客观,但无法确定病变确切位置。ABR对累及听觉中枢的病变敏感。GD脑干病变的ABR表现为后面的波逐渐消失,前面的波潜伏期延长。有时ABR异常早于其他神经病变表现,甚至早于系统性病变表现,因此ABR检查能够将脑干神经受累的诊断提前,特别是当怀疑有脑干病变、而影像学难以显示时,ABR对于GD诊断、分型、预后评估意义更大。定期ABR监测可发现脑干病变进展,评价药物对Ⅲ型GD的疗效。
当GD合并传导性耳聋时,不宜采用通风管或手术清理中耳病变,因手术无法改变中耳通气功能,术后易复发;建议采用保守治疗,患者交流障碍时可佩戴适宜的助听器,极重度听力减退者可行人工耳蜗植入术。
目前GD相关临床特征中,眼部受累研究相对较少,但从轻微的眼部表现到严重的眼球运动异常等各种类型眼部受累均可发生。
7.1.1 眼底改变
针对Ⅰ型GD患者的研究发现,患者玻璃体内有白色沉积物,其大小、形态和位置有所不同,有些分布在玻璃体腔,有些位于视网膜血管前。GD患者也可出现由于葡萄糖脑苷脂堆积而成的黄斑和视网膜前沉积物。GBA1基因纯合L444P突变患者眼底通常有玻璃体混浊、玻璃体凝缩或视网膜前白点。Ⅰ型患者的尸检结果显示,睫状体、视网膜神经节细胞、脉络膜和巩膜有不同程度的戈谢小体。Ⅰ型患者的视网膜电图(electroretinogram, ERG)反应减弱,可能是由于葡萄糖脑苷脂沉积引起的Mueller细胞缺陷导致。除视网膜和玻璃体沉积物外,通过光学相干断层扫描(optical coherence tomography, OCT)发现GD患者和杂合携带者视网膜变薄,而GBA活性丧失相关的氧化应激及线粒体功能障碍则是此种视网膜变性的原因。由于视网膜变薄与PD有关,因此GD患者的视网膜变薄可能是神经变性的早期临床标志[23]。
7.1.2 角膜混浊
角膜混浊也可见于GD患者,且Ⅲ型患者相对更常见[24]。基因型为GBA1 D409H/D409H的患者,其特征性的临床表现为心脏瓣膜钙化,且双眼角膜基质层的后部出现混浊。而角膜混浊有可能是葡萄糖脑苷脂累积在角膜基质细胞中导致。由于纯合D409H基因型的患者常常同时会有角膜混浊和心脏改变,因此具有此突变的患者需进行详细的眼科检查。
7.1.3 葡萄膜炎
既往研究发现,患者确诊GD之前即出现了葡萄膜炎[25]。部分患者表现为中度葡萄膜炎,激素治疗无效,但在用阿糖苷酶进行ERT后,部分患者眼内的混浊和视力一定程度上可得到改善。
7.1.4 结膜改变
Ⅰ型GD患者可有睑裂斑和结膜的淡黄色增厚。结膜活检可发现戈谢细胞浸润。睑裂斑并非GD特异性表现,其也可能与患者固有血清胆固醇水平有关。
7.1.5 眼球运动异常
GD患者均表现出不同程度的水平和垂直扫视异常,这些异常往往随着疾病的进展而恶化,且与其他神经系统疾病相关,包括智力、手眼协调能力等。眼球扫视运动减慢通常先累及向下和水平方向,早期不易被察觉,可用于区分Ⅲ型GD与其他类型的GD。选择性水平扫视减慢表明脑桥病变,而垂直凝视减慢则表明中脑上部病变(相对少见)。Ⅲ型患者的眼球运动异常更多见[26],其为一种核上性麻痹,表现为前庭-眼反射正常。典型的Ⅰ型(非神经病变型)表现为水平和垂直注视异常及眼球运动的失用,患者可发展为PD。这些眼球运动异常在疾病的诊断和随访过程中具有重要作用[27]。
7.1.6 斜视
斜视可见于GD患者,但严重的眼位偏斜多见于GD婴儿。并非所有患儿出生便发现斜视表现,其通常反映患者具有严重的脑部病变。因此,不建议进行手术矫正。此外,Ⅱ型GD患儿由于水平扫视缓慢或缺失从而继发代偿头位以及眨眼减少。
对GD患者进行眼部临床表现的各项评估值得重视,可指导临床治疗。ERG可作为一种潜在的工具筛查GD患者的视网膜受累情况。
对于特定的眼内症状可进行手术治疗,例如利用玻璃体切除术治疗玻璃体浑浊、玻璃体液化引起的视网膜脱离。
由于GBA不能穿过血脑或血视网膜屏障,因此ERT通常不能有效治疗GD患者眼相关临床症状。SRT旨在抑制底物葡萄糖脑苷脂的合成。最初有报道称SRT药物美格鲁特(Miglustat)能够穿过血脑屏障从而逆转GD患者的神经系统症状,包括异常扫视[28-29]。目前对于GD相关眼部表型及病理机制尚未进行充分研究,然而充分评估眼部表现包括病理改变对于GD患者的早期诊断、分型、治疗及效果评价均具有重要意义。
GD心脏受累极为罕见,目前仅有个案报道,确切发病率尚不明确。心肌病及瓣膜病为直观受累表现,亦可有继发于肺动脉高压的右心结构及功能异常,临床可表现为心力衰竭、心律失常以及心房扩大时血栓栓塞事件发生率升高等[30]。
心血管钙化是Ⅲc型患者的突出表现。钙化主要累及瓣膜、二尖瓣、主动脉瓣,亦可有主动脉、心肌及心包钙化。瓣膜功能异常以狭窄为主要表现。
肺动脉高压为GD较为常见的表现。右心在压力负荷作用下重构,可相继出现右心室肥厚、右心增大,失代偿后表现为临床右心衰竭,亦可表现为水肿、胸/腹腔积液等。
因GD代谢性疾病的本质,在心肌方面模拟浸润性心肌病表现,异常物质沉积致心肌厚度增加[31],超声心动图或心脏MRI提示室壁增厚,但心肌细胞比例相对减少或丧失,因此心电图上并无高电压,甚至表现为低电压。伴随心肌病的发生,临床上出现心力衰竭,限制性表现较为突出,以水肿、胸/腹腔积液等第三间隙水潴留为主要特点,疾病进展甚至失代偿后可出现收缩功能降低。因此心肌损伤及心力衰竭的标志物(如肌钙蛋白、脑钠肽)升高。心肌损伤的病理改变伴随电活动异常,可出现室速、室颤等恶性室性心律失常,以及心室内传导阻滞、高度房室传导阻滞甚至电机械分离;因限制性舒张功能障碍导致心房压力升高,心房扩大等结构异常随之出现,因此可出现房扑、房颤等房性心律失常。
针对心力衰竭所致的水肿等第三间隙水潴留,可予以利尿治疗。房扑首选射频消融,房颤可选择受体阻滞剂或胺碘酮控制心率,房扑、房颤患者心房内血流缓慢,可根据血栓及栓塞风险选择华法林、Xa因子或凝血酶抑制剂等新型口服抗凝药抗凝治疗。有症状或有客观记录的缓慢型心律失常可植入起搏器,室速、室颤参照心肌病一级或二级预防进行植入式心律转复除颤器。对于重度主动脉瓣或二尖瓣狭窄,需外科手术治疗。
Ⅰ型和Ⅲ型GD可累及呼吸系统,主要表现为肺动脉高压、间质性肺疾病[32]。因肺外脏器受累相关症状明显,呼吸系统症状易被忽视,需引起临床医师重视。p.Leu483Pro基因突变的GD患者容易出现呼吸系统受累。
戈谢细胞也可直接浸润肺实质、肺血管引起肺动脉高压或间质性肺疾病;Ⅲ型患者还需警惕神经系统病变及脊柱侧弯等病变继发的呼吸系统受累。常见的呼吸系统受累包括:(1)戈谢细胞在支气管、肺及肺血管浸润,引起肺动脉高压、间质性肺疾病,主要见于Ⅰ型和Ⅲ型[33]。其起病隐匿,早期可无明显不适,中晚期主要表现为咳嗽、活动后气短,在病程后期出现不同程度的低氧血症、紫绀、肺部爆裂音、浮肿等。(2)肺外脏器受累后继发呼吸系统病变,常见于:①晚期-终末期肝病引起的肝肺综合征,主要表现为站立位时明显的呼吸困难、低氧血症、紫绀,常有杵状指、浮肿;②GD中枢神经系统病变导致误吸引起吸入性肺炎、肺部感染等。(3)GD治疗相关的呼吸系统病变:GBA替代治疗引起药物相关性呼吸系统疾病不常见,但近年来应用的异体干细胞移植、骨髓移植等,可能引起慢性移植物抗宿主病,从而出现闭塞性细支气管炎等移植相关呼吸系统疾病。
9.2.1 肺功能:(1)指氧饱和度:建议在GD患者门诊随访中常规进行,有助于早期发现GD相关性呼吸系统疾病。(2) 动脉血气:可在指氧饱和度异常的患者中进行。(3)肺功能检查:包括肺弥散功能、通气功能、肺容量测定,GD受累主要表现为弥散功能下降,可伴有不同程度的限制性通气功能障碍。建议定期复查肺功能,尤其是有低氧血症或呼吸系统症状、体征的GD患者。
9.2.2 胸部影像学:胸部高分辨CT对于评价是否有GD呼吸系统受累价值较高,建议用于有气短、指氧饱和度异常的GD患者,尤其需关注CT中是否有肺间质改变、肺动脉增宽等肺动脉高压的表现[33]。
9.2.3 肺动脉高压:(1)完善心电图、心脏彩色多普勒超声检查,关注肺型P波及肺动脉压力,早期发现及评价肺动脉高压。(2)完善核医学检查,关注V/Q、首次肺扫描等,有助于明确是否存在肝肺综合征。
氧疗及康复治疗是GD呼吸系统受累治疗的基础;对于肺动脉高压患者,有个案报道认为伊马替尼治疗能使其获益,可以尝试;但对于GD相关性间质性肺疾病患者,目前尚无有效的治疗药物;终末期间质性肺疾病、重度肺动脉高压患者可尝试肺移植[32]。
与其他贮积性疾病不同,GD肾脏受累少见,其中有肾脏病理资料的仅为个案报道。临床可表现为不同程度的蛋白尿、镜下血尿、肾小管功能损伤,可出现肾功能不全甚至衰竭。
肾脏病理方面,戈谢细胞沉积为其特征性表现,主要沉积部位为肾小球、肾间质以及肾小管周围毛细血管;尤其对于脾切除术后的患者,戈谢细胞更易在肾脏等脏器沉积,进而可继发系膜细胞和基质增生,肾小管萎缩和间质纤维化,以及上皮细胞足突不同程度的融合。此外,部分病例可在系膜区或毛细血管襻出现IgA、IgM沉积,还可表现为膜增生性肾小球肾炎或局灶节段性肾小球硬化,与GD相关性并不明确。可能有戈谢细胞活化促发炎症反应、免疫系统激活参与其中,但也可能为合并情况。另一方面,GD患者肿瘤发生率升高,特别是血液系统恶性肿瘤,也可造成肾脏损伤[5]。经肾脏病理证实的有淋巴瘤肾脏浸润,以及AL型肾淀粉样变性病。
应针对GD进行ERT。如继发肾功能不全,应给予不同程度的肾脏支持治疗,如慢性肾脏病一体化治疗,或针对终末期肾病的肾脏替代治疗等。
主要用于对骨骼系统的评估,GD的典型征象是弥漫性骨质疏松和股骨远端膨大呈“锥形瓶样”改变(图2),受累骨质包括长骨、椎体、肋骨及手足骨。可发生病理性骨折、蜂窝状或粗大的溶骨性骨质破坏、骨梗死以及继发的修复性骨膜反应和骨质硬化性改变。
双侧股骨及腰椎MRI是评估骨髓浸润程度、判断有无骨质破坏及骨梗死最灵敏的影像学检查方法。
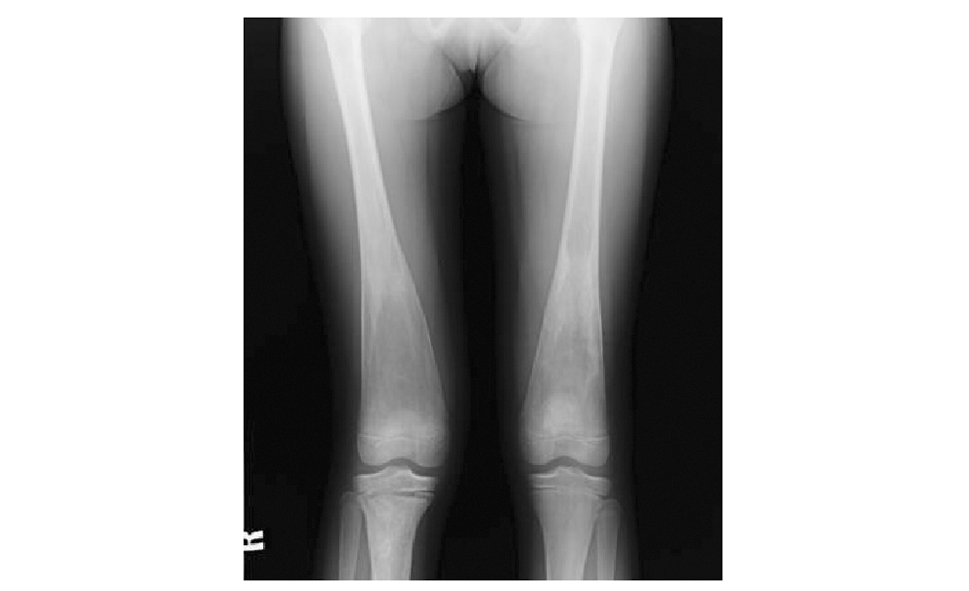
图 2 1例女性戈谢病患者,12岁,双侧股骨X线示骨质密度减低,远端膨大呈典型的“锥形瓶样”改变
戈谢细胞浸润骨髓,导致正常骨髓的T1WI、T2WI高信号降低,脂肪抑制T2WI序列可见信号增高。骨梗死在MRI上表现为典型的“地图样”改变(图3)。基于双侧股骨MRI平扫检查的骨髓负荷(bone marrow burden,BMB)评分法是使用最广泛的骨髓浸润分级体系[34-35](表1)。用定量评估骨髓脂肪含量的MRI序列,如Dixon定量化学位移成像、磁共振波谱可定量测量股骨及椎体的脂肪分数,脂肪分数越低,病情越重[35-36]。但患者年龄、合并骨折、退行性改变或继发的造血系统疾病等均会影响脂肪分数。
核医学单光子发射计算机断层显像(single photon emission computed tomography, SPECT)是潜在的可替代MRI用于GD的诊断手段。
目前,99mTc-甲氧基异丁基异腈(methoxyisobutylisonitrile,MIBI)显像剂可对GD骨髓受累进行显像的确切机制尚不清楚,可能与底物在溶酶体内贮积后引起的线粒体功能改变有关[37]。GD患者99mTc-MIBI显像骨髓受累的视觉评分与临床严重程度评分指数、相关实验室检查、传统影像学检查均有高度相关性。接受ERT的GD患者99mTc-MIBI 显像的视觉评分与临床严重程度评分指数、相关实验室检查、传统影像学检查均有高度相关性。接受ERT的GD患者99mTc-MIBI显像的视觉评分与患者接受ERT剂量呈现显著相关性。
99mTc-亚甲基二磷酸盐(methylene diphosphonate,MDP)全身骨显像可显示GD患者骨髓浸润、骨梗死/坏死[38],显像结果与MRI具有明显相关性,发现GD骨病变可早于临床症状。
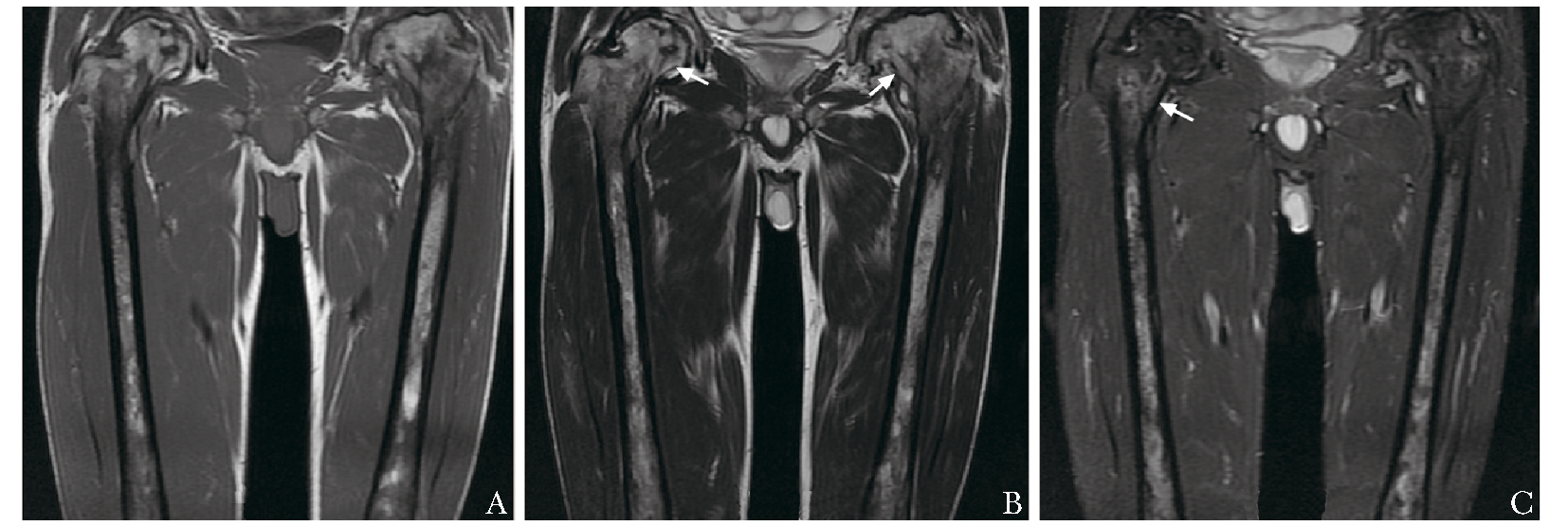
图 3 1例男性戈谢病患者,42岁,双侧股骨MRI示骨髓T1WI(A)、T2WI(B)高信号降低,脂肪抑制T2WI(C)可见骨髓为弥漫高低混杂信号,左侧股骨头塌陷,右侧股骨头及股骨颈可见多发骨梗死(箭头)
表 1 股骨BMB评分
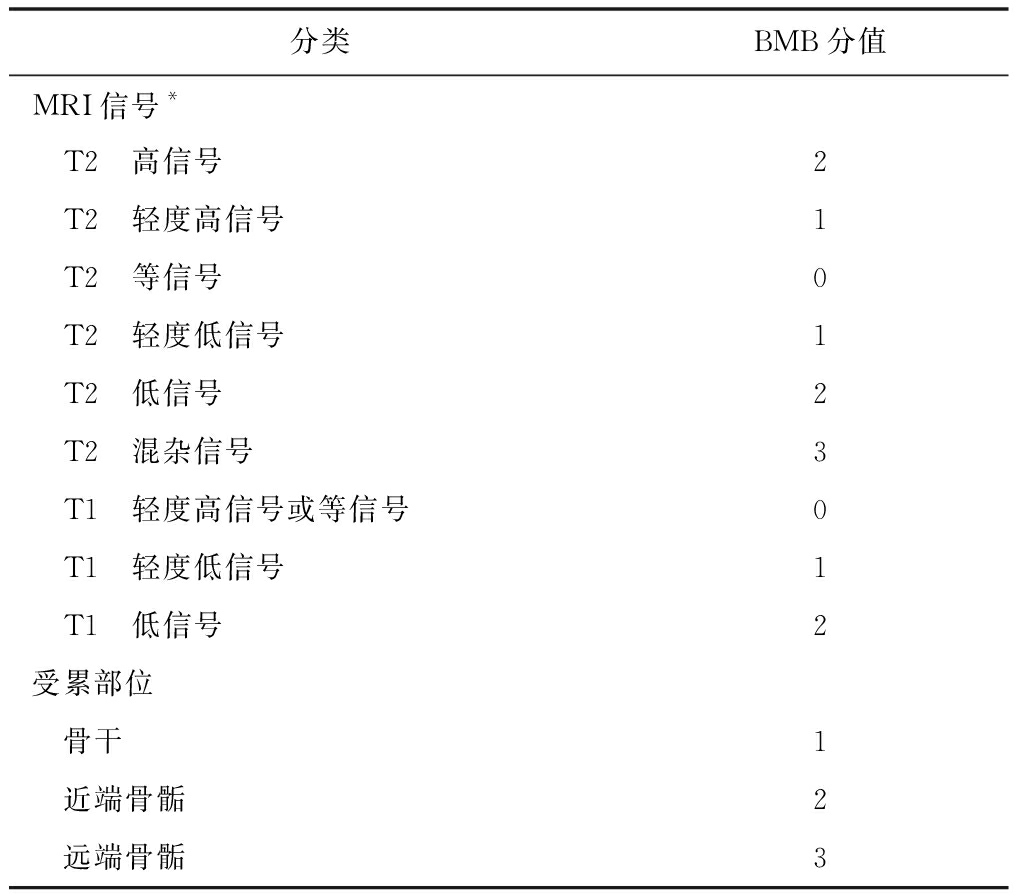
分类BMB分值MRI信号* T2 高信号2 T2 轻度高信号1 T2 等信号0 T2 轻度低信号1 T2 低信号2 T2 混杂信号3 T1 轻度高信号或等信号0 T1 轻度低信号1 T1 低信号2受累部位 骨干1 近端骨骺2 远端骨骺3
BMB:骨髓负荷,分值越高,代表骨髓受累越重;*与皮下脂肪比较
18F-氟脱氧葡萄糖(fluorodeoxyglucose, FDG) 显像对GD累及的骨髓灵敏度较高,视觉评分与临床严重程度评分指数具有高度相关性,通过CT肝、脾体积比值可评估患者对ERT的反应[39],且可排除疑似GD患者血液系统恶性疾病。
13.1.1 β-GBA
β-GBA活性检测应用人工合成底物4-MU-β-D-glucopyranoside,是诊断GD的金标准。GD患者外周血白细胞中β-GBA活性常降低至正常人活性5%以下。婴儿型与成人型GD患者残留酶活性不同,发病越早残留酶活性越低,成人临床症状轻的患者残留酶活性高,可高达正常均值的30%左右。在检测血白细胞β-GBA活性的同时,应进行白细胞中β-半乳糖苷酶或鞘磷脂酶活性检测。当临床表现明确GD,可仅测β-GBA活性,β-半乳糖苷酶作为参考酶同时进行检测。当GD与尼曼-皮克病在临床上难以区分时,可同时检测β-GBA和鞘磷脂酶。
β-GBA活性检测还可取患者皮肤成纤维细胞进行培养,患者酶活性均在正常人活性5%以下,易于区分,其缺点是该操作有创且培养时间较长。
13.1.2 壳三糖苷酶
血浆中壳三糖苷酶活性可用于监测GD患者ERT或小分子治疗疗效。该检测快速且廉价,但需注意的是,当编码壳三糖苷酶的基因CHIT1(NM_003465)存在c.1049_1072dup24(rs150192398,简称为dup24)重复突变(正常人群中该突变占30%左右)时,可导致壳三糖苷酶活性降低或缺失,导致评估结果不准。趋化因子CCL18检测可用于壳三糖苷酶缺失患者的临床检测[40]。严重的GD患者血浆中壳三糖苷酶活性可为正常值的几百甚至上千倍,尼曼-皮克病患者血浆中壳三糖苷酶活性也有升高,但相对低很多。
GBA双等位基因致病变异可致常染色体隐性遗传的GD。GBA基因位于1号染色体1q21,在下游16 kb处有一高度同源的假基因序列,目前已发现500多种不同的GBA基因突变,GBA基因突变型同样表现种族差异,并与临床表型相关,中国人GBA基因突变等位基因中Leu483Pro(L444P)最为常见,约占33%[41]。
β-GBA活性降低的患者可进一步行GBA基因分析。步骤如下:(1)设计引物,引物设计是GBA基因分析的最关键一步,用于筛选仅扩增GBA的基因。(2)用试剂盒提取患者外周血中DNA,经过PCR反应,上机测序;(3)通过序列比对找出突变。大部分患者,通过经典的Sanger测序均能检出突变,主要为错义突变和重组突变,少见为无义突变、小缺失、插入、剪切位点变异等。若仅检测到GBA基因的一个突变,可考虑进一步采用多重连接依赖探针扩增等方法寻找第二个等位基因突变。
值得注意的是,极个别患者外周血中活性虽然正常,但存在明显的GD临床表现,此时需考虑激活蛋白(saposin C)缺乏导致的GD,进一步行神经鞘脂激活蛋白Saposin C基因分析,从而确诊。
GD患者临床表现具有显著变异度,基因型与表型之间的相关性有限,这种临床差异的产生是众多修饰基因的作用结果。目前对于GD相关修饰基因的研究并不能解释患者中广泛的临床表型变异度,也未带来针对GD患者神经系统表型的新的治疗方案。但建立病理机制相关的修饰基因网络对阐明疾病致病机制、带来新的治疗可选方案等均有帮助。鉴定修饰基因通常的策略是全基因组关联分析,而这种研究方法的效力很大程度上取决于病例数的多少。目前GD的治疗方案研究正倾向于GD修饰基因,寻找更多的修饰基因用于解释该病的表型异质性很可能有利于寻求新的治疗措施[42]。
由于绒毛组织和羊水细胞中β-GBA均有表达,故产前诊断可选择早孕期11~13周取绒毛,直接检测绒毛组织中β-GBA活性,亦可选择中孕期17~20周取羊水,经羊水细胞培养后,检测经培养的羊水细胞中β-GBA活性。无论取绒毛还是羊水进行检测,均需同时进行基因分析。
作为GD的一线治疗,ERT可使肝脾体积回缩,改善贫血、血小板减少,缓解骨痛。但ERT药物属于大分子,不能透过血脑屏障,无法改善神经系统症状,因此不推荐用于急性神经病变型GD。
14.1.1 阿糖苷酶:阿糖苷酶由胎盘提取获得,疗效确切[43]。但由于制备工艺复杂且胎盘来源紧缺,90年代中后期,阿糖苷酶逐渐被重组基因技术制备的新型ERT药物取代。
14.1.2 伊米苷酶:伊米苷酶是利用基因重组技术结合中国仓鼠卵巢细胞培养技术获得的新型ERT药物,于1994年被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于Ⅰ型GD的ERT,并于2009年在中国批准上市。伊米苷酶治疗Ⅰ型GD 6个月内,患者贫血、血小板减少、肝脾肿大、骨痛、骨危象相关指标即可明显改善,治疗效果可稳定持续4年。伊米苷酶安全性良好,已报道的不良反应包括过敏反应及产生抗药抗体,大多数不良反应短暂且可逆[44]。
14.1.3 维拉苷酶:维拉苷酶利用人纤维母细胞基因激活技术生成,于2010年获美国FDA 批准上市。维拉苷酶初始用药剂量为60 U/kg,每2周输注一次,持续治疗12个月可显著改善贫血、血小板减少和肝脾肿大等特异性临床指标。此外,维拉苷酶的安全性良好,无药品相关严重不良事件[45]。
14.1.4 他利苷酶:他利苷酶通过重组DNA技术在胡萝卜细胞中生成,于2015年由美国FDA批准上市[46]。Ⅰ型GD患者每两周分别给予30、60 U/kg剂量的他利苷酶,肝脾体积缩小,血红蛋白水平提升,骨骼病理方面也有所改善。他利苷酶不良反应包括过敏反应和产生药物IgG抗体[47]。
SRT是通过抑制GBA的活性,降低葡萄糖脑苷脂的合成。该疗法适用于有残存酶活性的GD患者。与ERT相比,SRT为口服制剂,应用相对方便,减少了治疗所需时间。
14.2.1 美格鲁特:美格鲁特是一种小分子亚糖胺类物质,可竞争性抑制GBA。美格鲁特于2003 年7 月由美国FDA 批准上市,作为不能接受ERT的成人Ⅰ型GD的二线用药。美格鲁特可改善肝脾肿大,但对贫血、血小板减少的疗效有限,对骨骼症状的疗效仍有待评估。此外,尽管美格鲁特可透过血脑屏障,但尚无证据表明其对神经型GD患者有效。美格鲁特的不良反应包括腹泻、体质量减轻、震颤和可疑的周围神经病变[48]。
14.2.2 依利格鲁特:依利格鲁特是一种新型SRT口服药,作为神经酰胺类似物,发挥GBA活性抑制作用,从而减少葡萄糖脑苷脂的堆积。美国于2014年,欧盟于2015年批准该药用于成人Ⅰ型GD一线治疗,但尚未批准应用于儿童。依利格鲁特可改善血小板计数、血红蛋白、肝脾体积及骨骼相关临床指标。依利格鲁特体内代谢主要由CYP450家族中的CYP2D6介导,此外CYP3A4也少量参与,需警惕合用CYP2D6/CYP3A4抑制剂引起药物相互作用的可能性。根据基因分型,依利格鲁特不适用于CYP2D6超快代谢者,因其体内不能达到有效药物治疗浓度。药物剂量方面,CYP2D6中、快代谢者的推荐剂量为84 mg×2次/d;CYP2D6慢代谢者为84 mg×1次/d。与美格鲁特相比,依利格鲁特与GBA的作用特异度更高,对肠道双糖酶无抑制作用,不会引起胃肠道副作用。此外,依利格鲁特可被多药转运蛋白(Pgp-1)迅速转运出中枢神经系统,因此不会引起中枢神经系统不良反应[49]。
分子伴侣疗法通过稳定溶酶体错误折叠的蛋白质,来提高剩余β-GBA的活性。分子伴侣结合并稳定内质网中突变的β-GBA,促使其转运至溶酶体。溶酶体内酸性环境及堆积的葡萄糖脑苷脂诱导分子伴侣解离,释放有活性的β-GBA,降解溶酶体中底物。分子伴侣疗法是新兴治疗方向,尚处于研究中。目前发现的分子伴侣归类为:脱氧野尻霉素类、氨基环醇类、双环类和其他非糖来源的分子伴侣[50]。
脾脏增大导致缺血性脾梗死会出现急性腹痛、发热及脾脏周围炎症。本病很少出现脾脏破裂而导致外科急腹症。尽管ERT和SRT作为主要的治疗方法使一些患者避免了脾切除,但未经ERT和严重脾脏功能亢进的患者仍可考虑全脾或部分脾切除。
脾切除的适应证:巨脾或脾脏功能亢进明显者,年龄>4岁的Ⅰ型和Ⅲ型GD。全脾切除可明显改善临床症状,减轻贫血和出血倾向,改善发育状态。但脾切除后大量代谢物质在肝脏和骨骼蓄积,可能加速肝肿大和骨骼破坏,因此有学者提出尽量延缓脾切除术,必要时可考虑部分脾切除[51]。
异基因HSCT通过移植健康供体的造血干细胞,用产生β-GBA的造血干细胞替代有缺陷的单核细胞,一次性纠正酶缺陷,从而纠正内脏和骨骼变化,使进展期Ⅱ、Ⅲ型神经变化达到完全稳定,且成本较ERT明显降低。
Ⅰ型儿童期发病者为HSCT的最佳适应证,因其未累及神经系统,HSCT效果确切。对于Ⅱ型有先证者,未出现神经症状前可行HSCT;有神经症状者 HSCT疗效不稳定,不同患儿差异较大,故不推荐行HSCT。通常Ⅲ型神经症状较Ⅱ型出现晚,建议未出现神经症状前可行HSCT。
HSCT通常应在明显的肝功能损害和神经损伤等并发症(尤其是脾脏功能亢进)出现前进行,且因神经损伤所致的认知能力的恢复随年龄增大而减退,故保守建议HSCT应限于 10 岁以下未出现神经系统症状的儿童。
通常供者首选人类白细胞抗原(human leuko-cyte antigen,HLA)全相合的同胞,且经过缺陷酶及突变基因检测为无病非携带者,可采用其骨髓、外周血及脐血;如无HLA全相合同胞者,可选用健康的非血缘HLA 8/10、9/10、10/10脐带血,也可选择HLA 10/10全相合无关供者。有学者曾建议,健康的HLA全相合同胞经过缺陷酶及突变基因检测为无病杂合子者,也可选用其骨髓、外周血及脐血,移植后β-GBA活性可达正常水平的1%~5%,能够校正底物累积以发挥作用,但在供者来源较多的情况下,不建议采用此种方案。随着HLA配型和支持治疗等技术的提高,非血缘HLA 8/10或9/10相合的骨髓或外周血也可作为有效的供者来源之一。近年来,随着单倍体移植成功率的提高,父母虽然为基因携带者,β-GBA正常的情况下,也可作为供者来源之一。
关于移植前脾脏是否切除一直存在争论,对于脾脏功能亢进者,建议行脾部分切除且待伤口恢复后行移植治疗;未出现脾脏功能亢进者,建议不切除。有文献显示GD 早期脾切除会导致神经功能迅速恶化[52]。但未切除脾脏且行移植者,血小板植入天数明显增加,可能会出现输血无效甚至脾脏功能亢进。
多提倡采用清髓预处理方案[53-54]:白消安[3.2~4.4 mg/(kg·d)×4 d]/环磷酰胺[50 mg /(kg·d)×4 d]、白消安[3.2~4.4 mg/(kg·d)×4 d]/环磷酰胺[60 mg/(kg·d)×2 d]/氟达拉滨(120~180 mg/m2)、白消安[3.2~4.4 mg/(kg·d)×4 d]/马法兰(140~210 mg/m2)/氟达拉滨(150 mg/m2)。非清髓方案[55]如马法兰/氟达拉滨,因增加排斥率,故并不提倡。
采用联合多种免疫抑制剂预防移植物抗宿主病,以环孢菌素A或他克莫司(FK506)为基础,根据干细胞来源和HLA配型不同而不同,骨髓或外周干细胞移植中加用吗替麦考酚酯[25~30 mg/(kg·d),分2~3次给药]、短程甲氨蝶呤 (+1 d 15 mg/m2,+3 d、+6 d、+11 d 15 mg/m2)和抗胸腺球蛋白(7.5~10 mg/kg)。脐带血干细胞移植中加吗替麦考酚酯。
骨髓或外周干细胞:单个核细胞数应大于5×108/kg,CD34+细胞数应大于2.5×106/kg;脐带血干细胞数:单个核细胞数应大于5×107/kg,CD34+细胞数应大于2.5×105/kg。如果单份脐带血不能达到标准,可采用双份,HLA配型不合程度越高,单个核细胞和CD34+细胞数要求越高。
16.6.1 酶生化:在成功移植约3个月左右,白细胞中β-GBA的活性增加至预期值,在供者嵌合率稳定的情况下,β-GBA和壳三糖苷酶可达到长期正常化,β-葡萄糖脑苷脂底物逐渐消失[56]。
16.6.2 血液学特征:供者细胞完全植入后,骨髓和肝脏中戈谢细胞逐渐消失,GD表现的血液学变化完全纠正,泡沫巨噬细胞的完全消除可能仍需数月。
16.6.3 内脏和骨骼:在移植后6~12个月,肝脏和脾脏明显回缩;骨骼重塑,长骨缺损完全正常化,骨骼放射性改变缓慢但可完全改变,且骨痛和骨折可消除,骨骼增长速度较移植前明显好转,但一些伴有后凸畸形的患者尚未表现出完全重塑[57]。
16.6.4 神经系统特征:HSCT显示可成功纠正Ⅱ、Ⅲ型神经系统变化,但对移植后24个月死亡者进行尸检发现,尽管患者生前神经症状并未进展,但其脑组织中β-GBA水平仍较低[58],故HSCT在Ⅱ、Ⅲ型已发生神经功能缺损GD 中的作用仍有待更多研究加以证实。
GD酶缺陷仅限于造血细胞,故健康造血干细胞可完全替代所有缺陷细胞,其疗效优于其他溶酶体贮积症。HSCT治疗GD的并发症发生率极低,总生存率可超过85%。两个最大系列报道显示,供者型完全嵌合患儿可获得长期生存,目前随访时间最长的患者,22年无疾病复发,生存质量良好,无长期后遗症或移植物抗宿主病并发症[57,59]。为提高移植成功率,降低并发症,建议在移植前和过程中使用ERT。
GD因多脏器受累可合并营养及代谢异常。相当多的未治疗GD患者存在营养不足或生长发育落后,经ERT后依然营养不足;另一方面,又有部分GD患者存在超重或肥胖,在接受ERT治疗后体质量增长更为显著。对GD患者的营养状况评估应结合患者年龄、体质量指数、治疗史等,予以个体化营养管理方案。
经间接能量测定,GD患者的基础代谢率(basal metabolic rate, BMR)较健康对照组显著升高24%[60]。包括ERT、SRT在内的原发病治疗可一定程度改善患者高代谢状态,但并不能完全逆转升高的BMR[60]。成人可按照理想体质量25~30 kcal/(kg·d)计算基本能量摄入推荐,再根据患者的体质量指数、性别、年龄、活动度、应激状况调整为个体化能量标准。儿童/青少年建议参考SchofieldWN公式计算BMR,再根据患儿活动、应激状况、生长发育需要调整能量系数进一步计算。
17.3.1 碳水化合物
Ⅰ型GD患者罹患葡萄糖代谢障碍甚至糖尿病的发生率增高。营养管理中应予以合理碳水化合物摄入,兼顾糖脂代谢管理的需要。碳水化合物摄入量建议参考中国营养学会对于同年龄组健康人群的推荐摄入量标准[61]。建议首选低血糖生成指数的碳水化合物,避免添加糖类食品,充足摄入富含膳食纤维的食物。
以碳水化合物为主的必要膳食调整,有利于改善GD患者的药物耐受性。美格鲁特是Ⅰ型GD 的SRT治疗药物,可抑制蔗糖酶、麦芽糖酶等双糖酶而导致糖类在肠腔不能完全水解、增加肠腔内容物的渗透压,用药初期易见轻至中度腹泻、腹胀、腹痛等胃肠道不良反应。在启动SRT治疗前2周至治疗的1个月内应严格限制双糖(如蔗糖、麦芽糖、乳糖)摄入,适当减少碳水化合物的供能比例,以利于改善药物胃肠道耐受性[62]。
17.3.2 脂肪
未治疗的Ⅰ型GD患者可出现总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇降低,且后两者比值增大,脂蛋白apoA1、apoB降低,apoE升高。血脂谱的紊乱是发生胆道结石的危险因素,Ⅰ型GD患者发生胆系结石的比率约为32%~45.9%,尤以脾切除后为著[63]。建议GD患者适量摄入脂肪,限制饱和脂肪酸摄入,鼓励增加单不饱和脂肪酸及多不饱和脂肪酸的摄入比例。可参考中国营养学会、联合国粮食及农业组织、欧盟食品安全局对于同年龄组健康人群的脂肪推荐摄入量建议标准。
17.3.3 蛋白质
如患者未出现失代偿性肝硬化,建议参考同年龄蛋白质的推荐摄入量[61]。应保证膳食中含一定比例的优质蛋白质,一般建议动物和大豆蛋白质占膳食蛋白质总量的30%~50%。
17.4.4 矿物质及维生素
维生素不足或缺乏一定程度参与了GD患者骨代谢异常的发生,建议个体化评价钙、维生素D水平,评估个体年龄、体质量、人种、长住地、日照情况、膳食史、生活方式及合并疾病史,定义维生素D及钙的补充剂量。未治疗的GD患者维生素B12缺乏发生率增加,可根据血液系统、神经系统表现调整剂量及疗程。GD患者维生素与矿物质补充可参考一般情况下同年龄组的营养素推荐摄入量[61]。
骨痛是GD患者的常见症状,可使用视觉模拟评分进行评估。Ⅰ型患者多数无肌力异常,Ⅱ、Ⅲ型患者可能存在,但单纯肌力下降并不常见,可使用徒手肌力测试进行评估。四肢关节活动度受限不常见,脊柱后凸多见于Ⅲ型GD患者或椎体压缩型骨折患者,可通过X线判断后凸严重程度,通过量角器或卷尺判断脊柱的柔韧性。存在慢性神经病变的Ⅲ型GD患者多因共济失调或肌阵挛而存在步态问题,可通过肉眼观察进行评估,也可使用步态分析仪进行更精细的评估。认知功能可采用韦氏儿童智力量表(第3版)对认知功能进行筛查。言语功能和吞咽功能可由临床医师进行简单评估,或由言语治疗师对患者构音方面进行详细评估。运动耐力可进行6 min步行试验、往返穿梭试验等进行评估。患者个体水平可采用通用的功能独立性评定、Barthel指数等进行评估,社会参与水平可采用SF-36健康调查简表进行评估。
规律的运动(每周3~5次中等强度有氧运动以及2~3次抗阻训练)有助于Ⅰ型GD增强骨骼及肌肉、缓解疲乏、提高生活质量,但有出血倾向者,应避免接触性运动(如篮球、足球等);Ⅱ型GD多数病情进展较快,康复干预难以起效;Ⅲ型GD临床表现和病程差异大,可根据患者实际情况进行针对性康复训练。
在详细评估基础上,言语、吞咽障碍可予口腔肌肉协调性训练、构音改善训练,共济失调可行本体感觉训练、平衡训练,认知障碍可行反应时训练、注意的维持/选择/转移/分配训练。脊柱后凸可行改善胸椎后凸体操训练、支具佩戴等。PD症状可行放松训练、关节活动度训练、转移训练、平衡训练、步态训练、日常生活能力训练等。
本共识编写组成员(按姓氏汉语拼音排序):
陈丽萌(北京协和医院肾内科)、陈苗(北京协和医院血液内科)、陈伟(北京协和医院临床营养科)、韩冰(北京协和医院血液内科)、黄慧(北京协和医院呼吸与危重症医学科)、霍力(北京协和医院核医学科)、金丽日(北京协和医院神经科)、蒋显勇(北京协和医院血液内科)、李景南(北京协和医院消化内科)、李融融(北京协和医院临床营养科)、刘淑芬(北京协和医院物理医学康复科)、刘鑫(北京协和医院药剂科)、刘雅萍(中国医学科学院基础医学研究所医学遗传学系)、刘子文(北京协和医院基本外科)、梅丹(北京协和医院药剂科)、邱正庆(北京协和医院儿科)、睢瑞芳(北京协和医院眼科)、唐湘凤(解放军总医院第六医学中心儿科)、吴南(北京协和医院骨科)、吴志宏(北京协和医院骨科)、王凤丹(北京协和医院放射科)、王欧(北京协和医院内分泌科)、王轶(北京协和医院耳鼻喉科)、杨辰(北京协和医院血液内科)、于康(北京协和医院临床营养科)、张波(北京协和医院药剂科)、张磊(北京协和医院肾内科)、张为民(北京协和医院医研中心临床遗传学实验室)、仉建国(北京协和医院骨科)、朱慧娟(北京协和医院内分泌科)、朱燕林(北京协和医院心内科)
执笔人:韩冰、陈苗、杨辰
利益冲突:无
[1]中华医学会儿科学分会遗传代谢内分泌学组,中华医学会儿科学分会血液学组,中华医学会血液学分会红细胞疾病(贫血)学组.中国戈谢病诊治专家共识(2015)[J]. 中华儿科杂志,2015,53:256-261.
[2]Stirnemann J, Belmatoug N, Camou F, et al. A Review of Gaucher Disease Pathophysiology, Clinical Presentation and Treatments[J]. Int J Mol Sci, 2017,18:441.
[3]Zimran A.How I treat Gaucher disease[J]. Blood, 2011, 118:1463.
[4]Motta I, Filocamo M, Poggiali E, et al. A multicentre observational study for early diagnosis of Gaucher disease in patients with Splenomegaly and/or Thrombocytopenia[J]. Eur J Haematol, 2016,96:352-359.
[5]Lo SM, Stein P, Mullaly S, et al. Expanding spectrum of the association between Type 1 Gaucher disease and cancers: a series of patients with up to 3 sequential cancers of multiple types--correlation with genotype and phenotype[J]. Am J Hematol, 2010,85:340-345.
[6]Somaraju UR, Tadepalli K. Hematopoietic stem cell transplantation for Gaucher disease[J]. Cochrane Database Syst Rev, 2017,10:CD006974.
[7]Hughes D,Mikosch P, Belmatoug N, et al. Gaucher Disease in bone: From pathophysiology to Practice[J]. J Bone Miner Res, 2019,34: 996-1013.
[8]Casirati G, Baldini M, Ulivieri FM, et al. Skeletal involvement in type 1 Gaucher disease: Not just bone mineral density[J]. Blood Cells Mol Dis, 2018,68:148-152.
[9]Marcucci G, Zimran A, Bembi B, et al. Gaucher disease and bone manifestations[J].Calcif Tissue Int, 2014, 95:477.
[10]Ramirez JM, Eberson CP. The Role of Rehabilitation in the Management of Adolescent Idiopathic Scoliosis[J]. R I Med J, 2017, 100:22-25.
[11]Ka uzna M, Trzeciak I, Ziemnicka K, et al. Endocrine and metabolic disorders in patients with Gaucher disease type 1: a review[J]. Orphanet J Rare Dis, 2019, 14:275.
uzna M, Trzeciak I, Ziemnicka K, et al. Endocrine and metabolic disorders in patients with Gaucher disease type 1: a review[J]. Orphanet J Rare Dis, 2019, 14:275.
[12]Rite S, Baldellou A, Giraldo P, et al. Insulin-Like Growth Factors in Childhood-Onset Gaucher Disease[J]. Pediatr Res,2002, 52:109-112.
[13]Masi L, Brandi ML. Gaucher disease: The role of the specialist on metabolic bone diseases[J]. Clin Cases Miner Bone Metab, 2015, 12:165-169.
[14]Mikosch P, Hughes D. An overview on bone manifestations in Gaucher disease[J]. Wien Med Wochenschr,2010, 160:609-624.
[15]Giraldo P, Pérez-López J, Nú ez R, et al. Patients with type 1 Gaucher disease in Spain: A cross-sectional evaluation of health status[J]. Blood Cells Mol Dis, 2016, 56:23-30.
ez R, et al. Patients with type 1 Gaucher disease in Spain: A cross-sectional evaluation of health status[J]. Blood Cells Mol Dis, 2016, 56:23-30.
[16]Ucar SK, Coker M, Argin M, et al. A cross-sectional, mono-centric pilot study of insulin resistance in enzyme replacement therapy patients with Gaucher type I without overweight[J]. Mol Genet Metab,2009, 96:50-51.
[17]Roshan Lal T, Sidransky E. The Spectrum of Neurological Manifestations Associated with Gaucher Disease[J]. Diseases,2017,5:10.
[18]Sestito S, Filocamo M, Ceravolo F, et al. Norrbottnian clinical variant of Gaucher disease in Southern Italy[J]. J Hum Genet,2017, 62:507-511.
[19]Kraoua I, Stirnemann J, Ribeiro MJ, et al. Parkinsonism in Gaucher’s disease type 1: ten new cases and a review of the literature[J]. Mov Disord,2009,24:1524-1530.
[20]Capablo JL, Franco R, de Cabezón AS, et al. Neurologic improvement in a type 3 Gaucher disease patient treated with imiglucerase/miglustat combination[J]. Epilepsia, 2007,48:1406-1408.
[21]Campbell PE, Harris CM, Vellodi A. Deterioration of the auditory brainstem response in children with type 3 Gaucher disease[J]. Neurology,2004,63:385-387.
[22]Okubo Y, Goto M, Sakakibara H, et al. The absence of later wave components in auditory brainstem responses as an initial manifestation of type 2 Gaucher disease[J]. Pediatr Neurol,2014,51:837-839.
[23]McNeill A, Roberti G, Lascaratos G, et al. Retinal thinning in Gaucher disease patients and carriers: results of a pilot study[J]. Mol Genet Metab, 2013,109:221-223.
[24]Guemes A, Kosmorsky GS, Moodie DS, et al. Corneal opacities in Gaucher disease[J]. Am J Ophthalmol, 1998,126:833-835.
[25]Dann K, Althaus C, Kersten A, et al. Uveitis masquerade syndrome in Gaucher disease. Causal treatment by alglucer-ase substitution therapy[J]. Klin Monbl Augenheilkd,1998, 213:358-361.
[26]Accardo AP, Pensiero S, Perissutti P. Saccadic Analysis for Early Identification of Neurological Involvement in Gaucher Disease[J]. Ann N Y Acad Sci, 2005, 1039:503-507.
[27]Benko W, Ries M, Wiggs EA, et al. The saccadic and neurological deficits in type 3 Gaucher disease[J]. PLoS One,2011,6: e22410.
[28]Sawicka-Gutaj N, Machaczka M, Kulinska-Niedziela I, et al. The appearance of newly identified intraocular lesions in Gaucher disease type 3 despite long-term glucocerebrosidase replacement therapy[J]. Ups J Med Sci, 2016,121: 192-195.
[29]Accardo A, Pensiero S, Ciana G, et al. Eye movement impairment recovery in a Gaucher patient treated with miglustat[J]. Neurol Res Int, 2010,2010: 358534.
[30]Kör Y, Keskin M, Ba pinar O. Severe cardiac involvement in Gaucher type IIIC: a case report and review of the literature[J]. Cardiol Young,2017,27:1426-1429.
pinar O. Severe cardiac involvement in Gaucher type IIIC: a case report and review of the literature[J]. Cardiol Young,2017,27:1426-1429.
[31]Roghi A, Poggiali E, Cassinerio E, et al. The role of cardiac magnetic resonance to assess the cardiac involvement in Gaucher type 1 patients: morphological and functional evaluations[J]. J Cardiovasc Med (Hagerstown),2016, 18:244.
[32]Lo SM, Liu J, Chen F, et al. Pulmonary vascular disease in Gaucher disease: clinical spectrum, determinants of phenotype and long-term outcomes of therapy[J]. J Inherit Metab Dis,2011,34:643-650.
[33]Gawad T, Moneam A, Madkour S,et al. Pulmonary manifestations in young Gaucher disease patients: Phenotype-genotype correlation and radiological findings[J]. Pediatr Pulmonol, 2020,55:441-448.
[34]Biegstraaten M, Cox TM, Belmatoug N,et al. Management goals for type 1 Gaucher disease: An expert consensus document from the European working group on Gaucher disease[J]. Blood Cells Mol Dis,2018,68:203-208.
[35]Maas M, van Kuijk C, Stoker J, et al. Quantification of bone involvement in Gaucher disease: MR imaging bone marrow burden score as an alternative to Dixon quantitative chemical shift MR imaging--initial experience[J]. Radiology,2003,229:554-561.
[36]van Dussen L, Akkerman EM, Hollak CE, et al. Evaluation of an imaging biomarker, Dixon quantitative chemical shift imaging, in Gaucher disease: lessons learned[J]. J Inherit Metab Dis,2014,37:1003-1011.
[37]Platt FM, Boland B, van der Spoel AC. The cell biology of disease: Lysosomal storage disorders: The cellular impact of lysosomal dysfunction[J]. J Cell Biol, 2012,199:723-734.
[38]Lebtahi R, Belmatoug N, Scigliano S, et al. Gaucher disease: Diagnostic value of bone scintigraphy[J]. J Nucl Med,2008,49:267.
[39]Erba PA, Boni R, Sollini M, et al. Clinical application of [18F]FDG-PET/CT in gaucher’s disease[J]. J Nucl Med, 2012, 53: 2141.
[40]Raskovalova T, Deegan PB, Yang R, et al. Plasma chitotriosidase activity versus CCL18 level for assessing type I Gaucher disease severity: protocol for a systematic review with meta-analysis of individual participant data[J]. Syst Rev, 2017, 6:87.
[41]张为民,邓亮生,孟岩,等.中国人戈谢病基因突变的分析[J].中华医学杂志, 2009, 89: 3397-3400.
[42]Davidson BA, Hassan S, Garcia EJ, et al. Exploring genetic modifiers of Gaucher disease: The next horizon[J]. Hum Mutat,2018,39:1739-1751.
[43]Brady RO. Enzyme Replacement Therapy: Conception, Chaos and Culmination[J]. Philos Trans R Soc Lond B Biol Sci, 2003, 358:915-919.
[44]Weinreb N, Taylor J, Cox T,et al. A benchmark analysis of the achievement of therapeutic goals for type 1 Gaucher disease patients treated with imiglucerase[J]. Am J Hematol, 2008, 83:890-895.
[45]Gonzalez DE,Turkia HB, Lukina EA, et al. Enzyme replacement therapy with velaglucerase alfa in Gaucher disease: Results from a randomized, double-blind, multinational, Phase 3 study[J].Am J Hematol, 2013, 88: 166-171.
[46]Zimran A, Brill-Almon E, Chertkoff R, et al. Pivotal trial with plant cell-expressed recombinant glucocerebrosidase, taliglucerase alfa, a novel enzyme replacement therapy for Gaucher disease[J]. Blood, 2011,118:5767-5773.
[47]Grabowski GA, Golembo M, Shaaltiel Y, et al. Taligluce-rase alfa: An enzyme replacement therapy using plant cell expression technology[J]. Mol Genet Metab, 2014, 112:1-8.
[48]Zimran A. How I treat Gaucher disease[J]. Blood, 2011, 118:1463.
[49]Belmatoug N, Di Rocco M, Fraga C, et al. Management and monitoring recommendations for the use of eliglustat in adults with type 1 Gaucher disease in Europe[J]. Eur J Intern Med, 2017, 37:25-32
[50]Narita A, Shirai K, Itamura S,et al. Ambroxol chaperone therapy for neuronopathic Gaucher disease: A pilot study[J]. Ann Clin Transl Neurol, 2016,3:200-215.
[51]Pastores GM, Hughes DA. Gaucher Disease [M/OL]//Adam MP, Ardinger HH, Pagon RA, et al.GeneReviews®. Seattle (WA): University of Washington, July 27, 2000.
[52]Erikson A, Groth CG, Mansson JE, et al. Clinical and biochemical outcome of marrow transplantation for Gaucher disease of the Norrbottnian type[J]. Acta Paediatr Scand, 1990,79:680-685.
[53]Bartelink IH, van Reij EML, Gerhardt CE, et al. Fludarab-ine and exposure-targeted busulfan compares favorably with busulfan/cyclophosphamide-based regimens in pediatric hematopoietic cell transplantation: maintaining efficacy with less toxicity[J]. Biol Blood Marrow Transplant, 2014, 20:345-353.
[54]Tan EY,Boelens JJ,Jones SA,et al. Hematopoietic Stem Cell Transplantation in Inborn Errors of Metabolism[J].Front Pediatr,2019,7:433.
[55]Hanser MD, Filipovich AH, Davies SM.Allogeneic hematopoietic cell transplantation (HCT) in Hurler’s syndrome using a reduced intensity preparative regimen[J]. Bone Marrow Transplant,2008,41:349-353.
[56]Young E, Chatterton C, Vellodi A, et al. Plasma chitotriosidase activity in Gaucher disease patients who have been treated either by bone marrow transplantation or by enzyme replacement therapy with alglucerase[J]. J Inherit Metab Dis,1997,20:595-602.
[57]Hobbs JR, Jones KH, Shaw PJ, et al. Beneficial effect of pre-transplant splenectomy on displacement bone marrow transplantation for Gaucher’s syndrome[J]. Lancet,1987,1:1111-1115.
[58]Tsai P, Lipton JM, Sahdev I, et al. Allogenic bone marrow transplantation in severe Gaucher disease[J].Pediatr Res,1992,31:503-507.
[59]Ringden O, Remberger M, Svahn BM, et al. Allogeneic hematopoietic stem cell transplantation for inherited disorders: experience in a single center[J]. Transplantation, 2006,81:718-725.
[60]Corssmit EP, Hollak CE, Endert E, et al. Increased basal glucose production in type 1 Gaucher’s disease[J]. J Clin Endocrinol Metab, 1995,80:2653-2657.
[61]中国营养学会. 中国居民膳食营养素参考摄入量(2013版)[M].北京:科学出版社,2013.
[62]Belmatoug N, Burlina A, Giraldo P, et al. Gastrointestinal disturbances and their management in miglustat-treated patients[J]. J Inherit Metab Dis, 2011, 34:991-1001.
[63]Zimmermann A, Popp RA, Al-Khzouz C, et al. Cholelithia-sis in Patients with Gaucher Disease type 1: Risk Factors and the Role of ABCG5/ABCG8 Gene Variants[J]. J Gastrointestin Liver Dis, 2016, 25:447-455.
[64]Davies EH, Mengel E, Tylki-Szymanska A,et al.Four-year follow-up of chronic neuronopathic Gaucher disease in Europeans using a modifiedseverity scoring tool[J]. J Inherit Metab Dis, 2011, 34:1053-1059.
[65]Grabowski GA, Andria G, Baldellou A, et al. A Pediatric non-neuronopathic Gaucher disease: presentation, diagnosis and assessment[J]. Eur J Pediatr,2004,163:58.